Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi a là khối lương 2 chất
2KMnO4 => MnO2+ O2+ K2MnO4
nKMnO4=\(\frac{a}{142}\)-> nO2=\(\frac{a}{245}\)
2KClO3=> 3O2+2KCl
nKClO3=\(\frac{a}{122,5}\)-> nO2=\(\frac{a}{\frac{611}{3}}\)
ta sa sánh : \(\frac{a}{245}< \frac{a}{\frac{611}{3}}\)
=> KClO3 cho nhiều O2 hơn

Bài 4 :
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
0,4__________________________0,2
\(n_{KMnO4}=\frac{63,2}{158}=0,4\left(mol\right)\)
\(\Rightarrow V_{O2}=0,2.22,4=4,48\left(l\right)\)
Bài 5:
\(n_{KClO3}=\frac{24,5}{122,5}=0,2\left(mol\right)\)
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)
0,2_______________0,3__(mol)
\(n_{KMnO4}=\frac{24,5}{158}=0,155\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
0,155_________________________0,078__(mol)
\(\Rightarrow V_{O2}=0,078.22,4=1,75\left(l\right)\)
Vậy khi dùng lượng KMnO4 và KClO3 như nhau thì KClO3 điều chế được nhiều O2 hơn

1.
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)
\(n_{KClO3}=\frac{9,8}{122,5}=0,08\left(mol\right)\)
\(\Rightarrow n_{O2}=\frac{3}{2}n_{KClO3}=\frac{3}{2}.0,08=0,12\left(mol\right)\)
\(\Rightarrow V_{O2}=0,12.22,4=2,688\left(l\right)\)
2.
\(a,2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
\(b,n_{O2}=\frac{33,6}{22,4}=1,5\left(mol\right)\)
\(\Rightarrow n_{KMnO4}=2n_{O2}=2.1,5=3\left(mol\right)\)
\(\Rightarrow m_{KMnO4}=3.158=474\left(g\right)\)
3.
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
1____________________________0,5
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\left(1\right)\)
1____________________1,5
Đặt \(n_{KMnO4}=n_{KClO3}=1\left(mol\right)\)
\(V_{O2\left(1\right)}=0,5.22,4=11,2\left(l\right)\)
\(V_{O2\left(2\right)}=1,5.22,4=33,6\left(l\right)\)
Vậy nung KClO3 sẽ cho thể tích oxi nhiều hơn.

Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
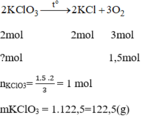
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
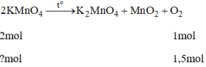
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.

gọi a là khối lương 2 chất
2KMnO4 -to> MnO2+ O2+ K2MnO4
nKMnO4=\(\dfrac{a}{142}\)->n O2=\(\dfrac{a}{245}\)
2KClO3-to> 3O2+2KCl
nKClO3=\(\dfrac{a}{122,5}\)->n O2=\(\dfrac{a}{\dfrac{611}{3}}\)
ta sa sánh : \(\dfrac{a}{245}\)<\(\dfrac{a}{\dfrac{611}{3}}\)
=> KClO3 cho nhiều O2 hơn
giả sử số gam của 2 chất là a
=> mKMnO4 = a/158 , mKClO3 = a/122,5
pthh : 2KMnO4 -t--> K2MnO4 +MnO2 + O2
a/158 -----------------------------------> a/316(mol)
2KClO3 -t---> 2KCl + 3O2
a/122,5---------------->3a/245(mol)
so sánh a/316 < 3a/245
=> KClO3 sinh ra có thể tích Oxi lớn hơn KMnO4

a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.

\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
\(\dfrac{m}{122,5}\) \(\dfrac{3m}{245}\) ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(\dfrac{m}{158}\) \(\dfrac{m}{316}\) ( mol )
So sánh:
\(\dfrac{3m}{245}\) > \(\dfrac{m}{316}\)
=> \(KClO_3\) cho nhiều O2 hơn

\(Coi\ n_{O_2} = 1(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 2(mol) \\ m_{KMnO_4} = 2.158 =316(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{2}{3}(mol)\\ m_{KClO_3} = \dfrac{2}{3}.122,5 = 81,6(gam)\\ \Rightarrow m_{KMnO_4} > m_{KClO_3}(316<81,6)\)

Câu 6.
\(n_{O_2}=\dfrac{16,8}{22,4}=0,75mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1,5 0,75
\(m_{KMnO_4}=1,5\cdot158=237g\)
Câu 7.
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,04 0,02
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{75}\) 0,04
\(m_{KClO_3}=\dfrac{2}{75}\cdot122,5=\dfrac{49}{15}\approx3,27g\)

Theo bài ra : KMnO4 và KClO3 có cùng khối lượng x (g)
Suy ra : nKMnO4 = \(\dfrac{x}{158}\) (mol)
nKClO3 = \(\dfrac{x}{122,8}\) (mol)
PTHH có : 2KMnO4 \(\rightarrow\) K2MnO4 + MnO2 + O2
(mol) \(\dfrac{x}{158}\) \(\dfrac{x}{316}\)
2KClO3 \(\rightarrow\) 2KCl + 3O2
(mol) \(\dfrac{x}{122,8}\) \(\dfrac{3x}{245,8}\)
Ta có: \(\dfrac{x}{136}< \dfrac{3x}{245,8}\) (mol)
Vậy Nếu lấy KClO3 và KMnO4 cùng khối lượng thì KClO3 điều chế đc nhiều oxi hơn.
. Có bài giống nè: Câu hỏi của Nguyen Tran Thao Nhi - Hóa học lớp 8 | Học trực tuyến