Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo định luật bảo toàn điện tích: 0,02.3+ 0,03.2=x + 2y
mmuối= 0,02.27+ 0,03.56 + 35,5.x+ 96.y=7,23
Suy ra x=0,06; y=0,03
Ta có: 2 cation: 0,02 mol Al3+, 0,03 mol Fe2+ và 2 anion: 0,06 mol Cl-, 0,03 mol SO42-
Suy ra 2 muối là FeCl2 và Al2(SO4)3

Bảo toàn điện tích:
x + 2y = 0,1 x 2 + 0,2 x 3 = 0,8
35,5x + 96y = 35,9
⇒ x = 0,2; y = 0,3

Đáp án C
Định luật bảo toàn điện tích: 0,1.2+ 0,2.3= x.1+ y.2
Định luật bảo toàn khối lượng: 0,1.56+ 0,2.27+ 35,5.x+ 96.y= 46,9
Suy ra x= 0,2; y=0,3

Đáp án C
n Al 3+ + 2 n Fe 2+ + n Na+ = 2 n SO4 2- + n Cl-
=> 2a + b = 0.8 (1)
m muối = m Al 3++ m Fe 2+ + m Na+ + m SO4 2- + m Cl- = 51,6 g
=> 96 a + 35,5 b = 35 ,9 g (2)
Giải (1) và (2 ) ta có a = 0,3 , b = 0,2

Đáp án B
Bảo toàn điện tích: nCl- = 3nAl3+ + 2nCu2+ - 2nSO42- = 0,1
mmuối =mAl3+ + mCu2+ + mSO42- + mCl- = 31,85g

0,1.3 + 0,1.2 = 0,2.2 + n Cl - → n Cl - = 0,1
Bảo toàn khối lượng → mmuối = 0,1.27 + 0,1.64 + 0,2.96 + 0,1.35,5 = 31,85g
Đáp án B

Chọn B
Bảo toàn điện tích có:
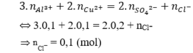
Bảo toàn khối lượng có:
mmuối = ∑mion = 0,1.27 + 0,1.64 + 0,2.96 + 0,1.35.5 = 31,85 (gam).

Câu 1:
Theo ĐLBT ĐT, có: x + 2y = 0,1.2 + 0,2.3 (1)
Theo ĐLBT KL, có: 35,5x + 96y = 44,4 - 0,1.56 - 0,2.27 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,4\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
Câu 2:
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 24y = 5,1 (1)
Có: \(n_{N_2}=0,05\left(mol\right)\)
Theo ĐLBT e, có: 3x + 2y = 0,05.10 (2)
Từ (1) và (2) \(\Rightarrow x=y=0,1\left(mol\right)\)
BTNT Al và Mg, có: \(n_{Al\left(NO_3\right)_3}=n_{Mg\left(NO_3\right)_2}=0,1\left(mol\right)\)
⇒ m muối = 0,1.213 + 0,1.148 = 36,1 (g)
Câu 3:
Có: \(n_{H^+}=0,2.0,01+0,2.0,02.2=0,01\left(mol\right)\)
\(n_{OH^-}=0,3.0,03=0,009\left(mol\right)\)
PT: \(H^++OH^-\rightarrow H_2O\)
__0,01___0,009 (mol)
⇒ H+ dư và nH+ (dư) = 0,001 (mol)
\(\Rightarrow\left[H^+\right]=\dfrac{0,001}{0,2+0,3}=0,002\left(M\right)\)
\(\Rightarrow pH=-log0,002\approx2,7\)
Bạn tham khảo nhé!

Đáp án C
Nhận thấy Mg2+ và H+ không thể tồn tại cùng với CO32-
→Dung dịch A chứa K+, NH4+, CO32- và ion âm An-
Theo định luật bảo toàn điện tích: 0,15+ 0,25=0,15.2+ n.nAn-
→ n.nAn-= 0,1 mol → Anion còn lại trong dung dịch A là Cl-
→Dung dịch A chứa K+, NH4+, CO32- và Cl-
→mchất rắn khan= 0,15.39 + 0,25.18+ 0,15.60 + 0,1.35,5= 22,9 gam
Dung dịch B chứa H+, Mg2+, SO42- và NO3-
Chú ý khi cô cạn thì axit HNO3 (0,2 mol) sẽ bay hơi cùng nước
→mchất rắn khan= mMg2++ mSO4(2-)+ mNO3- dư
= 0,1.24+ 96.0,075+ 0,05.62=12,7 gam