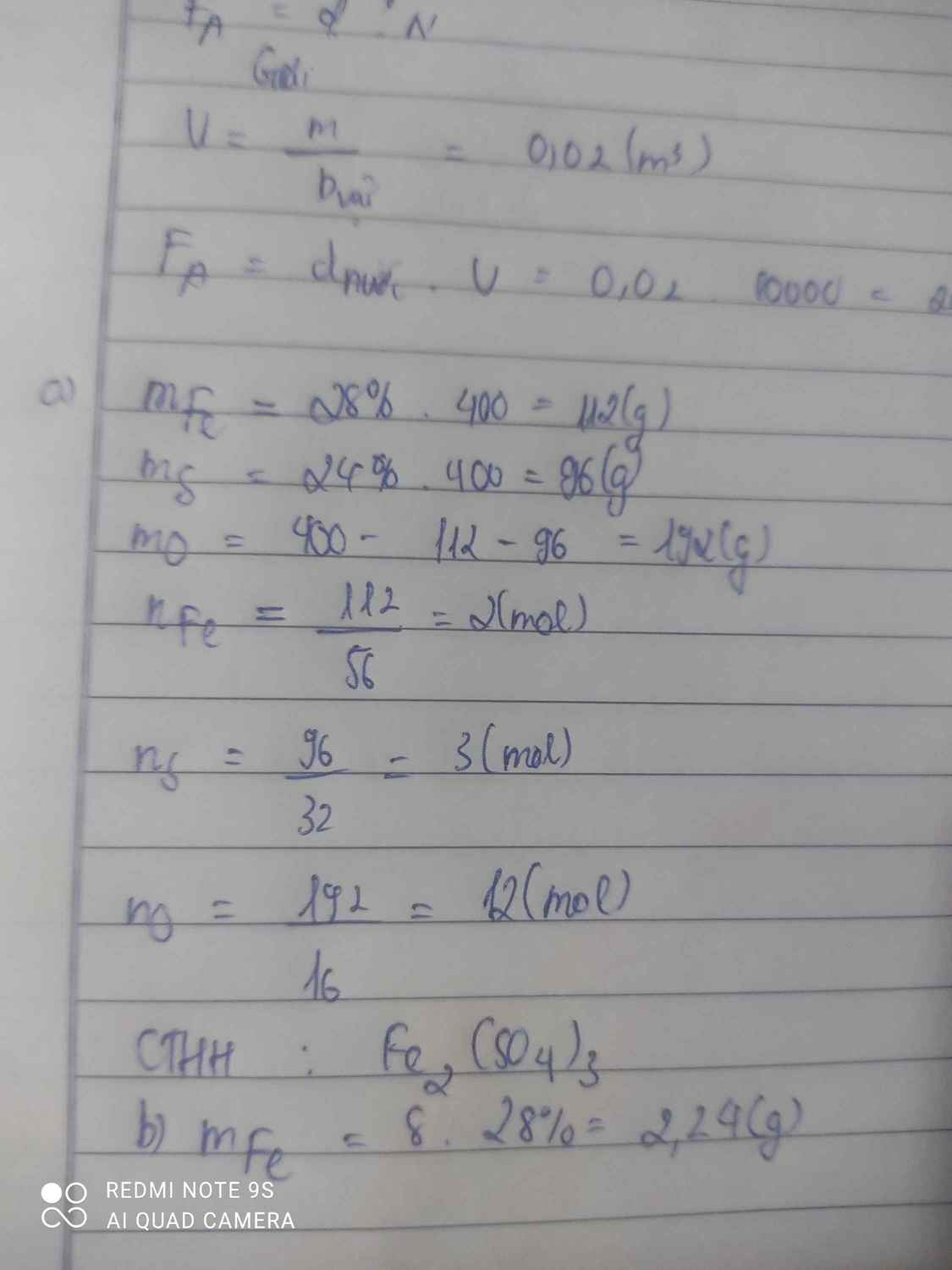Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 3. (1,5điểm) Chất rắn A màu xanh có thành phần Cu, S, O, H, trong đó nguyên tố oxichiếm 57,6%. Đun nóng 50 gam A thu được chất rắn B màu trắng có thành phần Cu, S, O và giải phóng 18 gam H2O. Khối lượng S trong B bằng \(\dfrac{1}{2}\) khối lượng Cu. Một phân tử A có chứa 5 phân tử H2O. Xác định công thức của A, B
Số mol A = \(\dfrac{18}{90}\)= 0,2 (mol)
=> Khối lượng mol A =\(\dfrac{50}{0,2}\)= 250 gam
Trong 1 mol A có: Khối lượng oxi = 0,576.250 = 144(g);
Khối lượng H = 10(g)
Khối lượng S = (250 – 144 – 10) : 3 = 32(g);
Khối lượng Cu = 64(g)
Trong 1 phân tử A có: 1 nguyên tử Cu, 1 nguyên tử S, 5 phân tử H2O và 4 nguyên tử O.
Công thức của A: CuSO4.5H2O
Công thức của B: CuSO4

Đáp án: CuSO4
Giải thích : gọi CTHH có dạng CuxSyOz
Theo bài ra ta có PTK của CuxSyOz = 160(đvC)
x.Cu=z.O= 2.y.S
Hay 64x =16z = 64y
⇒x=y= 1; z =4
CTHH cần tìm là CuSO4
TL
MY = 100 x 1,6 = 160 (g/mol)
Gọi công thức tổng quát: CuaSbOc
Theo đề ta có: 64a = 16c <=> 4a = b
64a = 32 x 2b <=> a = b
16c = 32 x 2b <=> c = 4b
Giải hpt ta có : a = 1 ; b = 1 ; c = 4
=> Công thức chung: (CuSO4)n
Với n = 1 => MY = 160 (nhận)
Với n = 2 => MY = 320 (loại)
=> Y là CuSO4
Khi nào rảnh vào kênh H-EDITOR xem vid nha!!! Thanks!

\(PTK_{hc}=\dfrac{NTK_S}{20\%}=\dfrac{32}{20\%}=160\left(đ.v.C\right)\\ Đặt.CTTQ:Cu_aSO_b\left(a,b:nguyên,dương\right)\\ a=\dfrac{160.40\%}{64}=1;b=\dfrac{40\%.160}{16}=4\\ \Rightarrow CTHH.hchat:CuSO_4\)

Gọi công thức của hợp chất CuSOx
Ta có : Mhc = 64 + 32 + 16.x = 160
=> x=4
=> Công thức của hợp chất : CuSO4
Gọi CTHH của hợp chất đó là CuSOx
Ta có: 64+32+16.x=160
<=>16x=64
<=> x=4
Vậy CTHH là CuSO4

a, %m\(_{Fe}\) = \(\frac{56\cdot2\cdot100\%}{56\cdot2+\left(32+16\cdot4\right)\cdot3}\)= 28(%)
%m\(_S\) = \(\frac{32\cdot3\cdot100\%}{56\cdot2+\left(32+16\cdot4\right)\cdot3}\)= 24(%)
%m\(_O\) = \(\frac{16\cdot4\cdot3\cdot100\%}{56\cdot2+\left(32+16\cdot4\right)\cdot3}\) = 48(%)
b, %m\(_O\) = 100% - 20% - 40% = 40(%)
Mà trong hợp chất có 4 nguyên tử Oxi
\(\Rightarrow\) M\(_{hợp}chất\) = \(\frac{40\cdot4\cdot100}{100}\) = 160 (g/mol)
\(\Rightarrow\) m\(_S\) = \(\frac{20\cdot160}{100}\)= 32 (gam )
\(\Rightarrow\) n\(_S\) = 32/32 = 1 (mol)
m\(_{Cu}\)= \(\frac{40\cdot160}{100}\) = 64 (gam)
\(\Rightarrow\) n\(_{Cu}\)= 64/64 = 1 (mol)
Vậy công thức hóa học của hợp chất trên là CuSO\(_4\)

a)Gọi hợp chất cần tìm là \(X_2O_3\)
Theo bài ta có: \(PTK_{X_2O_3}=76M_{H_2}=76\cdot2=152\left(đvC\right)\)
b)Mà \(2M_X+3M_O=152\Rightarrow M_X=\dfrac{152-3\cdot16}{2}=52\left(đvC\right)\)
X là nguyên tố Crom(Cr).
Vậy CTHH là \(Cr_2O_3\).
c)\(\%X=\dfrac{2\cdot52}{2\cdot52+3\cdot16}\cdot100\%=68,42\%\)

Gọi công thức hoá học của hợp chất là: \(Cu_xS_yO_z\)
Ta có: \(64x:32y:16z=40:20:40\)
\(\Rightarrow x:y:z=\dfrac{40}{64}:\dfrac{20}{32}:\dfrac{40}{16}\)
\(\Rightarrow x:y:z=1:1:4\)
Vậy công thức hoá học đơn giản của hợp chất B là: \(\left(CuSO_4\right)n\)
Ta lại có: \(\left(CuSO_4\right)n=160\)
\(\Rightarrow160n=160\)
\(\Rightarrow n=1\)
Vậy công thức hoá học của hợp chất B là:\(CuSO_4\)