Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Gọi n là hóa trị của kim loại R
\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
TĐB: \(\dfrac{4,05}{R}\) - \(\dfrac{4,05n}{R}\) - \(\dfrac{4,05}{R}\) - \(\dfrac{2,025n}{R}\) (mol)
\(n_R=\dfrac{m}{M}=\dfrac{4,05}{R}\left(mol\right)\)
\(m_{H_2}=n.M=\dfrac{2,025n}{R}.2=\dfrac{4,05n}{R}\left(g\right)\)
\(m_{ddRCl_n}=m_R+m_{ddHCl}-m_{H_2}\)
\(116,1=4,05+112,5-\dfrac{4,05n}{R}\)
\(\dfrac{4,05n}{R}=116,55-116,1\)
\(\dfrac{4,05n}{R}=0,45\)
\(4,05n=0,45R\)
\(\dfrac{4,05}{0,45}=\dfrac{R}{n}\)
\(9=\dfrac{R}{n}\)
\(9n=R\)
Nếu \(n=1\Rightarrow R=9\) (loại)
\(n=2\Rightarrow R=18\) (loại)
\(n=3\Rightarrow R=27\) (chọn)
Vậy kim loại R là Al
b) Kim loại tìm được là Al (III)
\(2Al+6H_2SO_{4\left(đ,t^0\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
TĐB: \(0,15\) - \(0,45\) (mol)
\(n_{Al}=\dfrac{m}{M}=\dfrac{4,05}{27}=0,15\left(mol\right)\)
\(m_{H_2SO_4}=n.M=0,45.98=44,1\left(g\right)\)
m\(m_{ddH_2SO_4}=\dfrac{m_{ct}.100\%}{C\%}=\dfrac{44,1.100\%}{98\%}=45\left(g\right)\)

1/Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.

O2 + C → t ∘ dư 2CO
Khí X là CO
Khi cho CO qua Al2O3 và Fe2O3 chỉ có Fe2O3 bị CO khử
Fe2O3 + 3CO → t ∘ 2Fe + 3CO2↑
Khí Y là CO2
Hỗn hợp rắn Z: Fe, Al2O3, có thể có Fe2O3 dư
Khí Y + Ca(OH)2 dư chỉ tạo ra muối trung hòa
CO2 + Ca(OH)2 → CaCO3↓trắng + H2O
Cho hỗn hợp Z vào H2SO4 loãng dư, không thấy có khí thoát ra => trong Z chắc chắn có Fe2O3 dư
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Gọi $n_{CuO} = a; n_{PbO} = b$
Ta có :
$80a + 223b = 15,15(1)$
$CuO + CO \xrightarrow{t^o} Cu + CO_2$
$PbO + CO \xrightarrow{t^o} Pb + CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
Theo PTHH :
$n_{CO_2} = a + b = \dfrac{10}{100} = 0,1(2)$
Từ (1)(2) suy ra a = b = 0,05
Vậy :
$m_{CuO} = 0,05.80 = 4(gam)$
$m_{PbO} = 0,05.223 = 11,15(gam)$

* Ồ , cố lên ☺☺*
a) - Ca(OH)2 dư =) nCaCO3=nCO2= 0,07 mol
. - bảo toàn Cacbon và oxi =) nO ( oxit) = 0,07 mol
. - mM( kim loại trong oxit )= 4,06-0,07*16=2,94g
bảo toản mol e => nM=2*nH2/n=0.105/n ( n lả số oxi hóa )
=> MM=2.94/(0.105/n)=28.n
=> n =2 => M = Fe
- n Fe = 0.0525
tỉ lệ nFe : nO =3:4 =) Fe3O4
b) nFe3O4=0,0175 mol
. 10H2SO4 + 2Fe3O4 → 3Fe2(SO4)3 + 10H2O + SO2
=) n Fe2(SO4)3 = 0,02625
=) CM = 0,0525M
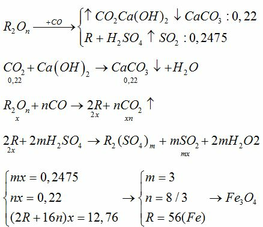

\(R_xO_y+yCO\underrightarrow{t^0}xR+yCO_2\)
TĐB: \(\dfrac{0,07}{y}\) - \(0,07\) - \(\dfrac{0,07x}{y}\) - \(0,07\) (mol)
\(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
TĐB: 0,07 0,07 0,07 0,07 (mol)
Gọi n là hóa trị của kim loại R
\(2R+2nHCl\rightarrow2RCl_n+nH_2\uparrow\)
TĐB: \(\dfrac{0,105}{n}\) - \(0,105\) \(0,0525\) (mol)
\(n_{BaCO_3}=\dfrac{m}{M}=\dfrac{13,79}{197}=0,07\left(mol\right)\)
\(n_{H_2}=\dfrac{m}{M}=\dfrac{0,105}{2}=0,0525\left(mol\right)\)
\(m_{CO_2}=n.M=0,07.44=3,08\left(g\right)\)
\(m_{CO}=n.M=0,07.28=1,96\left(g\right)\)
Áp dụng định luật bảo toàn khối lượng
\(m_{R_xO_y}+m_{CO}=m_R+m_{CO_2}\)
\(\Leftrightarrow4,06+1,96=m_R+m_{CO_2}\)
\(\Leftrightarrow6,02=m_R+3,08\)
\(\Leftrightarrow m_R=2,94\left(g\right)\)
\(m_R=n.M\)
\(\Leftrightarrow2,94=\dfrac{0,105}{n}.R\)
\(\Leftrightarrow\dfrac{2,94}{0,105}=\dfrac{R}{n}\)
\(\Leftrightarrow28n=R\)
Biện luận
Nếu n=1 \(\Rightarrow R=28\) (loại)
n=2 \(\Rightarrow R=56\) (nhận)
n=3 \(\Rightarrow R=84\) (loại)
Vậy kim loại R là Fe
\(m_{Fe_xO_y}=n.M\)
\(\Leftrightarrow4,06=\dfrac{0,07}{y}.\left(56x+16y\right)\)
\(\Leftrightarrow4,06y=3,92x+1,12y\)
\(\Leftrightarrow4,06y-1,12y=3,92x\)
\(\Leftrightarrow2,94y=3,92x\)
\(\Leftrightarrow\dfrac{2,94}{3,92}=\dfrac{x}{y}\)
\(\Leftrightarrow\dfrac{3}{4}=\dfrac{x}{y}\)
Vậy CTHH là \(Fe_3O_4\)
b)
\(2Fe_3O_4+10H_2SO_{4\left(đ,t^o\right)}\rightarrow3Fe_2\left(SO_4\right)_3+SO_2\uparrow+10H_2O\)
TĐB:0,0175 0,0875 (mol)
\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{4,06}{232}=0,0175\left(mol\right)\)
\(m_{H_2SO_4}=n.M=0,0875.98=8,575\left(g\right)\)
\(m_{ddH_2SO_4}=\dfrac{m_{ct}.100\%}{C\%}=\dfrac{8,575.100\%}{98\%}=8,75\left(g\right)\)