Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate vì
+ HCl tác dụng với oxide, hydroxide → Muối + H2O
+ HCl tác dụng với muối carbonate → Muối mới + CO2 + H2O
ứng dụng này dựa trên tính axit của HCl(có thể tác dụng với dung dịch bazơ, bazơ, oxit bazơ)

a)
- Dung dịch hydrochloric acid được dùng để trung hòa môi trường base: oxide base, base
=> Sử dụng dung dịch hydrochloric acid để tẩy rửa lớp copper(II) oxide tạo thành dung dịch muối và nước
- Phương trình hóa học:
CuO + HCl → CuCl2 + H2O
b) Các dung dịch có sẵn trong gia đình để tẩy rửa copper(II) oxide là: nước chanh, giấm ăn. Vì chúng có tính acid, có thể loại bỏ được lớp copper(II) oxide:
Acid + Oxide base → Muối + Nước

1) Dùng để sản xuất thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ, ...
2) Các công đoạn sản xuất H2SO4:
- Sản xuất SO2 (Đốt cháy lưu huỳnh/đốt quặng pirit sắt)
- Sản xuất SO3 (Oxi hóa SO2 bằng oxi/không khí dưở 450-500oC, xúc tác V2O5)
- Hấp thụ SO3 bằng H2SO4 (Dùng H2SO4 98% hấp thụ SO3 được oleum, dùng lượng nước thích hợp để pha loãng oleum)
3)
- Gồm 2 loại:
+ Muối trung hòa (muối sunfat): chứa ion SO42-
+ Muối axit (muối hidrosunfat): chứa ion HSO4-
4)
- Thường dùng dd muối bari hoặc dd Ba(OH)2

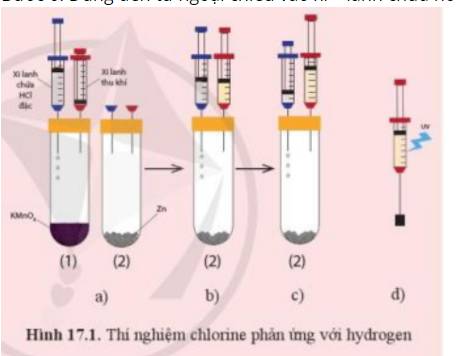
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI

Đáp án C
Vì khi thêm HCl thì khối lượng chất rắn khan thu được tăng lên nên ở lần 1 kim loại phản ứng dư và HCl hết, lần 1 có
![]() nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
Mà 2 lần có ![]()
nên lần 2 kim loại đã phản ứng hết.


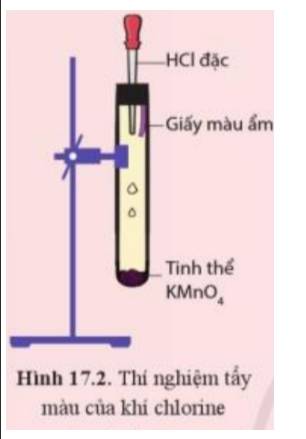
- Hiện tượng: Xuất hiện khí màu vàng và giấy màu ẩm bị nhạt màu dần rồi mất màu
- Giải thích:
+ Khi nhỏ HCl đặc vào tinh thể KMnO4, sản phẩm tạo thành có khí chlorine:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
+ Khí chlorine tác dụng với nước ở giấy màu ẩm tạo thành hỗn hợp có tính tẩy màu: HCl và HClO
Cl2(aq) + H2O(l) \( \rightleftharpoons \) HCl(aq) + HClO(aq)
=> Dung dịch này còn được gọi là dung dịch nước chlorine, có tính tẩy màu, sát khuẩn
- Khi thép được đưa qua các bể chứa dung dịch HCl để tẩy bỏ lớp rỉ sét
=> Thể hiện tính chất tác dụng với kim loại của hydrochloric acid, cụ thể là tác dụng với kim loại sắt
Fe + 2HCl → FeCl2 + H2
ứng dụng này dựa trên tính axit của HCl(có thể tác dụng với dung dịch bazơ, bazơ, oxit bazơ)