Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tên nguyên tố là photpho, kí hiệu hóa học là P.
Công thức hóa học của A là H 3 P O 4

Gọi công thức của A là H 3 X O y (vì nhóm X O y hóa trị III nên theo quy tắc hóa trị ta xác định được phân tử có 3 nguyên tử H)
Phân tử khối của H 2 S O 4 : 2 + 32 + 16.4 = 98 (đvC)
Vì A nặng bằng phân tử H 2 S O 4 nên PTK của A là 98 đvC
Theo đề bài, ta có khối lượng của nguyên tố oxi trong hợp chất là:
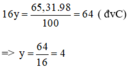
→ có 4 nguyên tử oxi trong hợp chất A.
Vậy nguyên tử khối của X là: 98 – (3 + 64) = 31 (đvC)

Gọi CTHH là \(X_2O_a\)
ta có \(MX_2O_a=6.MH_2O=6.18=108đvc\)
ta lại có
\(\%O=\dfrac{16.a}{108}.100\%=74,1\%=>a\sim5\)
ta có \(2.Mx+5.16=108đvc=>Mx=14đvc\)
vậy X là Nitơ (N)
=> CTHH là \(N_2O_5\)

a/ Hợp chất A là \(H_3XO_y\)
\(\Rightarrow M_A=3+X+16y=98\)
\(\Leftrightarrow X+16y=95\left(1\right)\)
Ta lại có: \(\dfrac{16y}{98}=0,6531\)
\(\Rightarrow y=4\)
Thế vào (1) ta được \(X=95-4.16=31\)
Vậy \(\left\{{}\begin{matrix}y=4\\X:P=31\end{matrix}\right.\)
b/ X là Phốt pho. CTHH A là \(H_3PO_4\)

a. Gọi CTHH của A là: X2Oa
Theo đề, ta có: \(d_{\dfrac{A}{H_2O}}=\dfrac{M_A}{M_{H_2O}}=\dfrac{M_A}{18}=6\left(lần\right)\)
=> MA = 108(g)
Theo đề, ta lại có:
\(\%_{X_{\left(A\right)}}=\dfrac{2M_X}{108}.100\%=100\%-74,1\%=25,9\%\)
=> \(M_X\approx14\left(g\right)\)
=> X là nitơ (N)
Ta lại có: \(PTK_A=14.2+16.a=108\left(đvC\right)\)
=> a = 5
b. CTHH của A là: N2O5
\(CT:H_3\left(XO_y\right)\)
\(M_A=98\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow X+16y=95\left(1\right)\)
\(\%O=\dfrac{16y}{98}\cdot100\%=65.31\%\)
\(\Rightarrow y=4\)
\(\left(1\right):X=31\left(P\right)\)
\(A:\) axit photphoric
\(H_3PO_4\)