Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Gọi số mol etan là x ; số mol etilen là y. Ta có hệ phương trình :
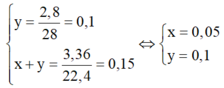
- Chọn đáp án A.

Đặt :
nC2H4 = a (mol) , nC2H2 = b(mol)
nC2H6 = 4.48/22.4 = 0.2 (mol)
=> a + b = 0.5 - 0.2 = 0.3 (1)
m tằn = mC2H4 + mC2H2 = 8.1 (g)
=> 28a + 26b = 8.1 (2)
(1) , (2) :
a = 0.15
b = 0.15
%C2H2 = 0.15/0.5 * 100% = 30%

\(n_{C_2H_5}=\frac{1,12}{22,4}=0,05\left(mol\right)\)
\(\rightarrow m_{C_2H_5}=0,05.29=1,45\left(g\right)\)
\(\rightarrow\%m_{C_2H_5}=\frac{1,45}{7,7}.100\%\approx18,83\%\)
\(m_{C_2H_4,C_3H_4}=7,7-1,45=6,25\left(g\right)\)
gọi số mol của etilen là a;propin là b ta có:
26a+40b=6,25(1)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_3H_4+2Br_2\rightarrow C_3H_4Br_4\)
\(n_{Br_2}=\frac{40}{160}=0,25\left(mol\right)=n_{C_2H_4}+2n_{C_3H_4}\)
\(\Leftrightarrow a+2b=0,25\left(2\right)\)
từ (1) và (2) ta có hệ:
\(\left\{{}\begin{matrix}26a+40b=6,25\\a+2b=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=\frac{5}{24}\\b=\frac{1}{48}\end{matrix}\right.\)
\(\%m_{C_2H_4}=\frac{\frac{5}{24}.26}{7,7}.100\%\approx70,35\%\)
\(\%m_{C_3H_4}=\frac{\frac{1}{48}.40}{7,7}.100\%\approx10,82\%\)
Khi thoát ra ra là Etan
\(n_{C_2H_6}= \dfrac{1,12}{22,4} = 0,05(mol)\)
Gọi \(n_{C_2H_4} =a (mol) ; n_{C_3H_4} = b(mol) \Rightarrow 28a +40 b = 7,7-0,05.30 = 6,2(1)\)
\(C_2H_4 + Br_2 \to C_2H_4Br_2\\ C_3H_4 + 2Br_2 \to C_3H_4Br_4\\ n_{Br_2} = a + 2b = \dfrac{40}{160}=0,25(2)\\ (1)(2)\Rightarrow a = 0,15 ; b = 0,05\\ \%V_{C_2H_6} = \%V_{C_3H_4} = \dfrac{0,05}{0,05 + 0,15 + 0,05}.100\% = 20\%\\ \%V_{C_2H_4} = \dfrac{0,15}{0,05 + 0,05 + 0,15}.100\% = 60\%\)

- Do dung dịch brom dư, nên khí thoát ra là metan.
![]()
- Chọn đáp án A.

Đáp án A
X1 gồm
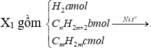
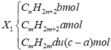
Vì X1 làm nhạt màu Br2 → CmH2m dư.
nX1 = 0,02 mol → nH2 = 0,025 - 0,02 = 0,005 mol.
mbình Br2 tăng = mCmH2m dư = 0,345 gam.
A2 gồm CnH2n + 2: b mol; CmH2m + 2: a mol.
nX2 = 0,0125 mol; MX2 = 1,283 x 29 = 37,2.
Trong X2 có b = 0,0125 - 0,005 = 0,0075 mol.
a + b + c = 0,025 → c = 0,0125 mol.
CmH2mdu = c - a = 0,0075
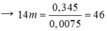
→ m = 3,3 → C3H6 và C4H8.
Theo BTKL:
mX = mX1 = mA2 + manken dư
= 37,2 x 0,0125 + 0,345 = 0,81 gam.
Trong X: mH2 = 2 x 0,005 = 0,01 mol
→ mCmH2m = 14m x c = 0,575 mol
→ mCnH2n + 2 = 0,225 gam.
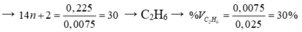
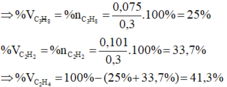
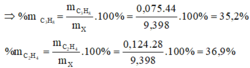

Đề chưa đủ em vì etilen tác dụng Br2 tỉ lệ 1:1 , propin tác dụng Br2 tỉ lệ 1:2, còn etan không tác dụng. Check lại đề hi