Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có nMg= 0,06 mol; nAl= 1/15 mol
QT cho e :
Mg → Mg2++ 2e
Al→ Al3++ 3e
Có ne cho=2.nMg+ 3.nAl= 0,32 mol
QT nhận e
-Nếu khí X có 1 nguyên tử N: Gọi số oxi hóa của N trong X là a
N+5 + (5-a) e→ N+a
(5-a).0,04 0,04
Theo ĐL bảo toàn electron có: 0,32= 0,04. (5-a)→ a= -3→ Loại
-Nếu khí có 2 nguyên tử N:
2N+5 + 2(5-a) e→ N2+a
(5-a).0,08 0,04
Theo ĐL bảo toàn electron có: 0,32= 0,08. (5-a) → a= +1
→ Khí X là N2O
Đáp án C

Đáp án C
nHNO3 bị khử = nN (sp khử) = nNO + 2nN2 = 0,1 + 2.0,05 = 0,2 mol

Đáp án C
Phương pháp:
nHNO3 bị khử = nN (sp khử) = nNO + 2nN2
Hướng dẫn giải:
nHNO3 bị khử = nN (sp khử) = nNO + 2nN2 = 0,1 + 2.0,05 = 0,2 mol

Có : nFe = nAl = nMg = 0,12 mol
Y : N2 ; N2O ; NO và NO2( N2 và NO2 có số mol bằng nhau)
=> Qui đổi : NO2 +N2 -> NO + N2O
=> Y trở thành : NO và N2O với số mol lần lượt là x và y.
Có : MY = 37g => mY = 37(x + y) = 30x + 44y
=> x = y(1)
Giả sử có z mol NH4NO3 trong muối
Bảo toàn e : 3nFe + 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3
=> 3x + 8y + 8z = 0,96 mol(2)
Và : nHNO3 = (4x + 10y + 10z)
=> nH2O = ½ (nHNO3 – 4nNH4NO3) = (2x + 5y + 3z) mol
Bảo toàn khối lượng :
mY = mKL + mHNO3 – mH2O - mmuối X = (216x + 540y + 576z) – 62,52 = 37(x + y)
=> 179x + 503y + 576z = 62,52(3)
Từ (1),(2),(3) => x = y = 0,06 ; z = 0,0375 mol
=> nHNO3 pứ = 4x + 10y + 10z = 1,215 mol

Ở ví dụ 4, ta đã giải quyết câu hỏi này bằng bảo toàn nguyên tố, giờ với phương trình liên hệ mol H+ và sản phẩm khử, ta có ngay: nH+ = 12nN2 + 4nNO = 12.0,01 + 4.0,02 =0,2 mol
Chọn đáp án D

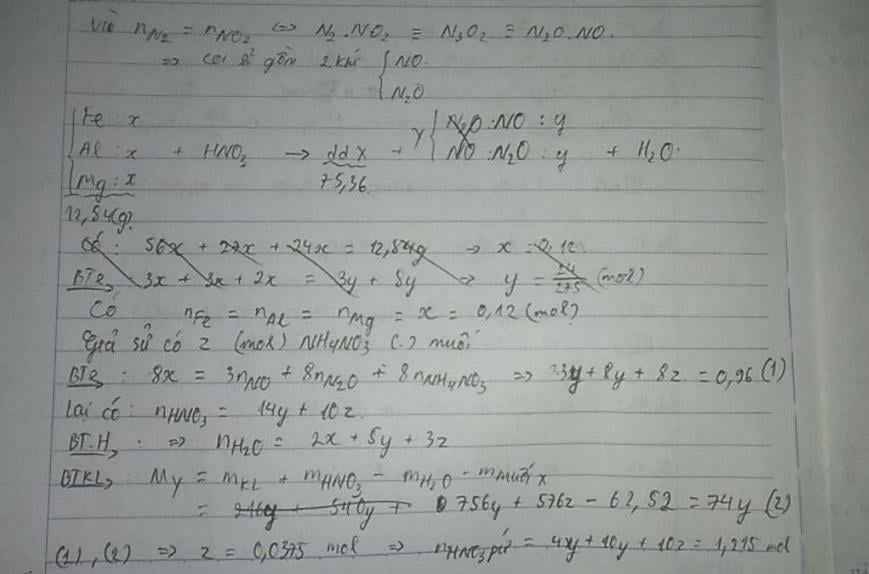

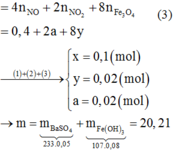

Sự thay đổi e:
\(Al^0\rightarrow Al^{+3}+3e\)
\(2N^{+5}+10e\rightarrow2N^0\)
\(N^{+5}+3e\rightarrow N^{+2}\)
Có: Số mol e nhường = số mol e nhận
\(\Leftrightarrow3.n_{Al}=10.n_{N_2}+3.n_{NO}\)
\(\Leftrightarrow3.n_{Al}=10.0,03+0,02.3\)
\(\rightarrow n_{Al}=0,12mol\)
Khối lượng của Al là: \(m_{Al}=0,12.27=3,24g\)