Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(n_{H2}=n_{H2SO4}=0,4\left(mol\right)\)
\(\Rightarrow C\%_{ddH2SO4}=\dfrac{0,4.98}{200}.100\%=19,6\%\)

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Gọi x, y lần lượt là số mol Al, Fe
Theo đề bài ta có hệ pt
\(\left\{{}\begin{matrix}27x+56y=8,3\\\dfrac{3}{2}x+y=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
a)\(x=\dfrac{\dfrac{0,1.3}{2}+0,1}{0,2}=0,25M\)
b)\(\%m_{Al_2(SO_4)_3}=\dfrac{\dfrac{0,1}{2}.342}{\dfrac{0,1}{2}.342+0,1.152}.100=52,94\%\)
=> %mFeSO4=100-52,94=47,06%
c)\(CM_{Al_2(SO_4)_3}=\dfrac{0,05}{0,2}=0,25M\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
d) 1> Thu được kết tủa bé nhất
-TH1 : Lượng KOH chỉ phản ứng với FeSO4 tạo kết tủa, không đủ để tạo kết tủa với Al2(SO4)3
\(2KOH+FeSO_4\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
=> \(m_{ddKOH}=\dfrac{0,1.2.56}{15\%}=74,67\left(g\right)\)
TH2: Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 sau đó tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6+0,1\right).56}{15\%}=224\left(g\right)\)
2> Thu được kết tủa lớn nhất :
Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 và không tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6\right).56}{15\%}=186,67\left(g\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\left(mol\right)\) \(a\) \(1,5a\) \(0,5a\) \(1,5a\)
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\left(mol\right)\) \(b\) \(b\) \(b\) \(b\)
Ta có hpt: \(\left\{{}\begin{matrix}27a+56b=8,3\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\)
\(a.x=\dfrac{1,5a+b}{0,2}=\dfrac{0,15+0,1}{0,2}=1,25\left(M\right)\\ b.\%m_{Al}=\dfrac{27.0,1}{8,3}.100=32,53\left(\%\right)\\ \%m_{Fe}=100-32,53=67,47\left(\%\right)\\ c.C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,5a}{0,2}=0,25\left(M\right)\\ C_{M_{FeSO_4}}=\dfrac{b}{0,2}=0,5\left(M\right)\\ d.\)
\(PTHH:Al_2\left(SO_4\right)_3+6KOH\rightarrow3K_2SO_4+2Al\left(OH\right)_3\)
\(\left(mol\right)\) \(0,05\) \(0,3\) \(0,1\)
\(PTHH:FeSO_4+2KOH\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
\(\left(mol\right)\) \(0,1\) \(0,2\)
\(PTHH:Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
\(\left(mol\right)\) \(0,1\) \(0,1\)
\(d.1.\) Lượng kết tủa bé nhất khi kết tủa \(Al\left(OH\right)_3\) sinh ra tan hết trong dd KOH
Khi đó: \(n_{KOH}=0,6\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,6.100.56}{15}=224\left(g\right)\)
\(d.2.\) Lượng kết tủa lớn nhất khi KOH tác dụng vừa đủ với dd A
Khi đó: \(n_{KOH}=0,5\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,5.56.100}{15}=186,67\left(g\right)\)

a) Gọi hóa trị của kim loại cần tìm là n
A-----> A+n + ne
S+6 +2e -----> S+4
Áp dụng bảo toàn e : \(n_A=\dfrac{n_{SO_2}.2}{n}=\dfrac{0,6}{n}\)
Ta có: \(\dfrac{19,2}{A}=\dfrac{0,6}{n}\)
Chạy nghiệm theo n:
n=1 --------> A=32 (lọai)
n=2 -------> A=64 ( chọn - Cu)
n=3 ------->A=96 (loại)
Vậy kim loại A là Đồng (Cu)
b) Giả sử phản ứng tạo 2 muối
Gọi x, y lần lượt là số mol KHSO3 và K2SO3
=> \(\left\{{}\begin{matrix}x+y=0,3\\120x+158t=39,8\end{matrix}\right.\)
=> x=0,2, y=0,1 (thỏa mãn)
=> \(n_{KOH}=0,2+0,1.2=0,4\left(mol\right)\)
=> \(CM_{KOH}=\dfrac{0,4}{0,4}=1M\)

a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

\(Mg + 2HCl \rightarrow MgCl_2 + H_2\)
\(Zn + 2HCl \rightarrow ZnCl_2 + H_2\)
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{H_2}= \dfrac{10,08}{22,4}= 0, 45 mol\)
Theo PTHH:
\(n_{-Cl}= 2n_{H_2}= 0,9 mol\) ( gốc Cl ở muối nhé)
\(m_{muối}= m_{kim loại} + m_{-Cl} \Rightarrow 56,6=a + 0,9 . 35,5 \Rightarrow a=24,65g\)

\(a,n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow n_{Al}=0,2(mol)\\ \Rightarrow m_{Al}=0,2.27=5,4(g)\\ b,m_{hh}=5,4+12,8=18,2(g)\\ c,n_{HCl}=0,6(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,3}=2M\)
a) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
_____0,2<----0,6<---------------0,3
=> mAl = 0,2.27 = 5,4(g)
b) mhh = 5,4 + 12,8 = 18,2(g)
c) \(C_{M\left(HCl\right)}=\dfrac{0,6}{0,3}=2M\)
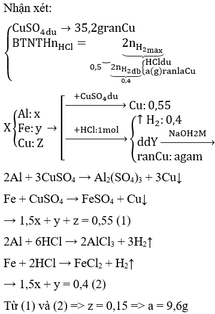
Sửa đề dung dịch axit clohidric phải là HCl chứ nhỉ
\(n_{H2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2<----0,6<-------------------0,3
\(a=m_{Al}=0,2.27=5,4\left(g\right)\)
\(x=C_{MddHCl}=\dfrac{0,6}{0,2}=3\left(M\right)\)