Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa đề dung dịch axit clohidric phải là HCl chứ nhỉ
\(n_{H2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2<----0,6<-------------------0,3
\(a=m_{Al}=0,2.27=5,4\left(g\right)\)
\(x=C_{MddHCl}=\dfrac{0,6}{0,2}=3\left(M\right)\)

\(1.n_{H_2SO_4}=\dfrac{294\cdot0,2}{98}=0,6mol\\ n_{oxide}=\dfrac{0,6}{3}=0,2mol\\ M_{oxide}=\dfrac{32}{0,2}=160\\ M_{KL}=\dfrac{1}{2}\left(160-16\cdot3\right)=56\left(Fe\right)\\ Oxide:Fe_2O_3\)
\(a.Zn+2HCl->ZnCl_2+H_2\\ ZnO+2HCl->ZnCl_2+H_2O\\ b.n_{Zn}=\dfrac{2,24}{22,4}=0,1mol\\ m_{Zn}=6,5g\\ n_{HCl}=0,3mol\\ m_{ZnO}=\dfrac{71\left(0,3-0,2\right)}{2}=3,55g\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,Zn+2HCl\to ZnCl_2+H_2\\ b,n_{ZnCl_2}=0,1(mol)\\ \Rightarrow m_{ZnCl_2}=0,1.136=13,6(g)\\ c,n_{Zn}=0,1(mol)\\ \Rightarrow \%_{Zn}=\dfrac{0,1.65}{20}.100\%=32,5\%\\ \Rightarrow \%_{Ag}=100\%-32,5\%=67,5\%\)

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
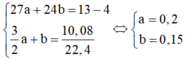
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.
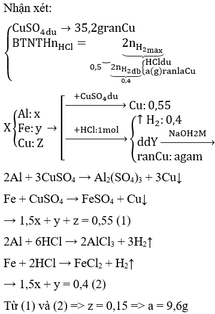
\(Mg + 2HCl \rightarrow MgCl_2 + H_2\)
\(Zn + 2HCl \rightarrow ZnCl_2 + H_2\)
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{H_2}= \dfrac{10,08}{22,4}= 0, 45 mol\)
Theo PTHH:
\(n_{-Cl}= 2n_{H_2}= 0,9 mol\) ( gốc Cl ở muối nhé)
\(m_{muối}= m_{kim loại} + m_{-Cl} \Rightarrow 56,6=a + 0,9 . 35,5 \Rightarrow a=24,65g\)
tks bn nha!!!!