Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 3:
nKOH = 1.0,05 = 0,05 (mol);nHCl=0,5.0,5=0,25 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,0125 0,0125
PTHH: 2KOH + FeCl2 → 2KCl + Fe(OH)2
Mol: 0,05 0,025
Ta có:\(\dfrac{0,25}{2}>\dfrac{0,0125}{1}\) ⇒ HCl dư, FeCl3 pứ hết
⇒ m=0,0125.56 = 0,7 (g)
Bài 4:
a,Nếu cho giấy quỳ tím vào dung dịch sau phản ứng thì màu của giấy quỳ tím sẽ không thay đổi màu sắc
b,\(n_{NaOH}=0,5.0,15=0,075\left(mol\right);n_{HCl}=1.0,15=0,15\left(mol\right)\)
PTHH: NaOH + HCl → NaCl + H2O
Mol: 0,075 0,075 0,075
Ta có:\(\dfrac{0,075}{1}< \dfrac{0,15}{1}\) ⇒ NaOH pứ hết , HCl dư
mNaCl = 0,075.58,5 = 4,3875 (g)
c, Vdd sau pứ = 0,15 + 0,15 = 0,3 (l)
\(C_{M_{ddNaCl}}=\dfrac{0,075}{0,3}=0,25M;C_{M_{ddHCldư}}=\dfrac{0,15-0,075}{0,3}=0,25M\)
Bài 5:
a,\(n_{BaCl_2}=\dfrac{100.20,8\%}{208}=0,1\left(mol\right);n_{Na_2SO_4}=\dfrac{150.14,2\%}{142}=0,15\left(mol\right)\)
PTHH: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Mol: 0,1 0,1 0,1
Ta có: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\)⇒ BaCl2 pứ hết, Na2SO4 dư
\(\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
b,mdd sau pứ = 100+150 = 250 (g)
\(C\%_{ddNaCl}=\dfrac{0,2.58,5.100\%}{250}=4,68\%\)
\(C\%_{ddNa_2SO_4dư}=\dfrac{\left(0,15-0,1\right).142.100\%}{250}=2,84\%\)

\(Đặt:n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_{hh}=27a+56b=8.3\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Tathấy:\)
\(n_{HCl}=2n_{H_2}=2\cdot0.25=0.5\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0.5}{0.2}=2.5\left(l\right)\)
\(n_{H_2}=1.5a+b=0.25\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(C_{M_{AlCl_3}}=\dfrac{0.1}{2.5}=0.04\left(M\right)\)
\(C_{M_{FeCl_2}}=\dfrac{0.1}{2.5}=0.04\left(M\right)\)
Chúc em học tốt !!!
a, Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(l\right)\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 8,3 (1)
Các quá trình:
\(Al^0\rightarrow Al^{+3}+3e\)
x___________ 3x (mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
y____________2y (mol)
\(2H^++2e\rightarrow H_2^0\)
______0,5__0,25 (mol)
Theo ĐLBT mol e, có: 3x + 2y = 0,5 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
BTNT Al và Fe, có: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\\n_{FeCl_3}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow C_{M_{AlCl_3}}=C_{M_{FeCl_3}}=\dfrac{0,1}{2,5}=0,04M\)
Bạn tham khảo nhé!

a) Ta có: \(\left\{{}\begin{matrix}n_{Cu}=\dfrac{0,32}{64}=0,005\left(mol\right)\\n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\end{matrix}\right.\)
Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+27b=0,87-0,32=0,55\) (1)
Bảo toàn electron: \(2a+3b=2n_{H_2}=0,04\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,005\\b=0,01\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeSO_4}=n_{Fe}=0,005\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,005\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow C_{M_{FeSO_4}}=\dfrac{0,005}{0,3}\approx0,02\left(M\right)=C_{M_{Al_2\left(SO_4\right)_3}}\)
b)
Ta thấy trong 0,87 gam hh X có 0,005 mol Fe, 0,005 mol Cu và 0,01 mol Al
\(\Rightarrow\) Trong 2,61 gam hh X có 0,015 mol Fe, 0,015 mol Cu và 0,03 mol Al
PTHH: \(2Fe+6H_2SO_{4\left(đặc\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(Cu+2H_2SO_{4\left(đặc\right)}\xrightarrow[]{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
\(2Al+6H_2SO_{4\left(đặc\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Ta có: \(n_{H_2SO_4}=3n_{Fe}+3n_{Al}+2n_{Cu}=0,165\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,165\cdot98}{78\%}\approx20,73\left(g\right)\)

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=0,2.1,5=0,3\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) => Mg hết, H2SO4 dư
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,2-->0,2------>0,2----->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
\(\left\{{}\begin{matrix}C_{M\left(MgSO_4\right)}=\dfrac{0,2}{0,2}=1M\\C_{M\left(H_2SO_4.dư\right)}=\dfrac{0,3-0,2}{0,2}=0,5M\end{matrix}\right.\)

a)
Gọi số mol Fe, Al là a, b (mol)
=> 56a + 27b = 19,3 (1)
\(n_{H_2}=\dfrac{14,56}{22,4}=0,65\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a--->a---------------->a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b---->1,5b------------------->1,5b
=> a + 1,5b = 0,65 (2)
(1)(2) => a = 0,2 (mol); b = 0,3 (mol)
mFe = 0,2.56 = 11,2 (g); mAl = 0,3.27 = 8,1 (g)
b)
\(n_{H_2SO_4}=0,65\left(mol\right)\)
=> \(C_{M\left(dd.H_2SO_4\right)}=\dfrac{0,65}{0,2}=3,25M\)
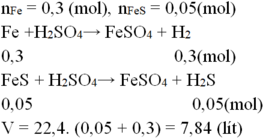
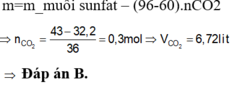
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,15 0,15 0,15
\(n_{H2}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,15.22,4=3,36\left(l\right)\)
\(n_{H2SO4}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
300ml = 0,3l
\(C_{MddH2SO4}=\dfrac{0,15}{0,3}=0,5\left(M\right)\)
Chúc bạn học tốt