Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt nCu = x(mol); nZn=y(mol)
=> 64x + 65y = 12,9
Bảo toàn electron ta lại có: ne nhường = ne nhận
=> 2 . n Cu + 2 . n Zn = 2 n SO 2 + 6 n S
=> 2x + 2y = 0,4 => x = y = 0,1 (mol)
Vậy phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
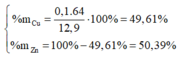

Nhận thấy 9,2 gam oxit > 8,4 gam X → nên Ag+, Cu2+ phản ứng hết
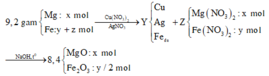
Gọi số mol Fe tham gia phản ứng là y mol, số mol Fe dư là x mol
→ nO2 pư để tạo thành Fe2O3 = y/4 mol
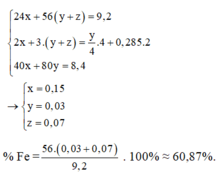
Đáp án A

Quy đổi hỗn hợp X thành Fe (a mol) và O (b mol)
Các quá trình nhường và nhận electron:
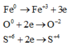
Theo định luật bảo toàn khối lượng ta có: 56a + 16b = 49,6 (1)
Theo định luật bảo toàn electron ta có: 0,4.2 + 2b = 3a (2)
(1) và (2) => a = 0,7; b = 0,65 (mol)
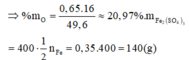
Đáp án A

\(n_{SO2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
a 0,15 1a
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
b 0,075 1,5b
a) Gọi a là số mol của Cu
b là số mol của Fe
\(m_{Cu}+m_{Fe}=18\left(g\right)\)
⇒ \(n_{Cu}.M_{Cu}+n_{Fe}.M_{Fe}=18g\)
⇒ 64a + 56b = 18g (1)
Theo phương trình : 1a + 1,5b = 0,375(2)
Từ(1),(2), ta có hệ phương trình :
64a + 56b = 18g
1a + 1,5b = 0,375
⇒ \(\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
b) 0/0Cu = \(\dfrac{9,.6.100}{18}=53,33\)0/0
0/0Fe = \(\dfrac{8,4.100}{18}=46,67\)0/0
c) Có : \(n_{Cu}=0,15\left(mol\right)\Rightarrow n_{CuSO4}=0,15\left(mol\right)\)
\(n_{Fe}=0,15\left(mol\right)\Rightarrow n_{Fe2\left(SO4\right)3}=0,075\left(mol\right)\)
\(m_{CuSO4}=0,15.160=24\left(g\right)\)
\(m_{Fe2\left(SO4\right)3}=0,075.400=30\left(g\right)\)
Chúc bạn học tốt

Đáp án D
Sơ đồ quá trình:
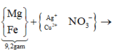
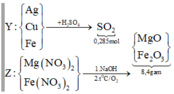
Gọi số mol Mg là x mol, Fe trong Y là y mol và Fe trong Z là z mol.
Ta có hệ phương trình:
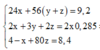
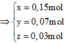
Theo đó, ![]()

\(3,68g\left\{{}\begin{matrix}Fe\\Mg\end{matrix}\right.+HNO3->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Mg\left(NO3\right)2\end{matrix}\right.+5,376\left(l\right)NO2\)
Bảo toàn e :
\(3x+2y=0,24\)
Ta có :
\(\left\{{}\begin{matrix}56x+24y=3,68\\3x+2y=0,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%mFe=\dfrac{0,04.56}{3,68}=60,87\%\\\%mMg=\dfrac{0,06.24}{3,68}=39,13\%\end{matrix}\right.\)
Bảo toàn nguyên tố Fe và Mg :
\(nFe=nFe\left(NO3\right)3=0,04\left(mol\right)\)
\(nMg=nMg\left(NO3\right)2=0,06\left(mol\right)\)
Ta có : \(nHNO3pu=0,04.3+0,06.2=0,24\left(mol\right)\)
\(\Rightarrow mHNO3=0,24.63=15,12\left(g\right)\)

Đáp án D
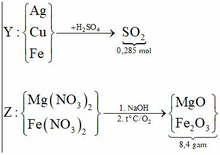
(Mg, Fe) + (AgNO3, Cu(NO3)2) => 3 kim loại
=> Chứng tỏ Mg, AgNO3, Cu(NO3)2 phản ứng hết, Fe còn dư; 3 kim loại là Ag, Cu, Fe.
Dung dịch Z chứa Mg(NO3)2 và Fe(NO3)2.
Đặt số mol Mg, Fe phản ứng, Fe dư lần lượt là a, b, c
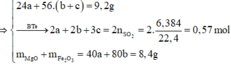
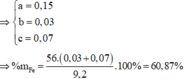

n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam
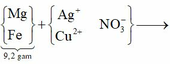


\(n_{SO_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PTHH: \(2Al+6H_2SO_4\underrightarrow{t^o}Al_2\left(SO_4\right)_3+3SO_2+6H_2O\\ Mg+2H_2SO_4\underrightarrow{t^o}MgSO_4+SO_2+2H_2O\)
Đặt \(n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\)
Ta có \(\left\{{}\begin{matrix}27a+24b=7,65\\1,5a+b=0,375\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{27.0,15}{7,65}.100\%=52,94\%\\ \%m_{Mg}=100\%-52,94\%=47,06\%\)
.