Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, BTNT N, có: nHNO3 (bị khử) = nNO + 2NN2O = 0,4 + 2.0,1 = 0,6 (mol)
b, Giả sử: nAl = mMg = x (mol)
Các quá trình:
\(Al^0\rightarrow Al^{+3}+3e\)
x___________ 3x (mol)
\(Mg^0\rightarrow Mg^{+2}+2e\)
x_____________ 2x (mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
_____ 1,2 __ 0,4 (mol)
\(2N^{+5}+8e\rightarrow N_2^{+1}\)
_______0,8__0,1 (mol)
Theo ĐLBT mol e, có: 3x + 2x = 1,2 + 0,8 ⇒ x = 0,4 (mol)
⇒ nAl = nMg = 0,4 (mol)
BTNT Al, có: nAl(NO3)3 = nAl = 0,4 (mol)
BTNT Mg, có: nMg(NO3)2 = nMg = 0,4 (mol)
BTNT N, có: nHNO3 (pư) = 3nAl(NO3)3 + 2nMg(NO3)2 + nNO + 2nN2O
= 3.0,4 + 2.0,4 + 0,4 + 2.0,1 = 2,6 (mol)
c, m = mAl + mMg = 0,4.27 + 0,4.24 = 20,4 (g)
Bạn tham khảo nhé!

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)

Đáp án B
Gọi
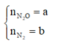
Có
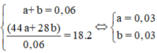
Ta có nAl = 0,46 Þ ne nhường = 3nAl = 1,38mol
Nếu sản phẩm khử có NH4NO3 thì
![]()
Do đó sản phẩm khử có chứa NH4NO3
Áp dụng định luật bảo toàn mol electron, ta có:
n e n h ư ờ n g = n e n h ậ n
![]()

Khi đó
![]()
Chú ý: Đề bài cho đồng thời các dữ kiện để có thể tính được số mol nhôm và số mol các sản phẩm khử là các khí, trong khi để tính được lượng muối nitrat của kim loại thì chỉ cần một trong hai dữ kiện trên.
Khi đó đề bài có vẻ "thừa". Tuy nhiên những bài như vậy thường có sự tạo thành muối amoni nền các bạn cần kiểm tra có sự tạo thành muối này không thông qua việc so sánh giữa số mol electron cho và số mol electron nhận.

Đặt $n_{NO}=2a(mol);n_{NO_2}=a(mol)$
Bảo toàn e ta có: $6a+a=0,1.3+0,25.3\Rightarrow a=0,15(mol)$
Do đó $n_{A}=0,15.3=0,45(mol)\Rightarrow V_A=10,08(l)$
tham khảo trong:
https://moon.vn/hoi-dap/hoa-tan-hoan-toan-hon-hop-gom-01-mol-fe-va-025-mol-al-vao-dung-dich-hno3-du-thu-duoc-530914

Ta có: \(n_{NO}+n_{NO_2}+n_{N_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\left(1\right)\)
Mà: mX = 35,8 (g)
\(\Rightarrow30n_{NO}+46n_{NO_2}+28n_{N_2}=35,8\left(2\right)\)
Có: \(n_{Al}=\dfrac{32,4}{27}=1,2\left(mol\right)\)
\(n_{Cu}=\dfrac{22,4}{64}=0,35\left(mol\right)\)
BT e, có: 3nNO + nNO2 + 10nN2 = 3nAl + 2nCu = 4,3 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,3\left(mol\right)\\n_{NO_2}=0,4\left(mol\right)\\n_{N_2}=0,3\left(mol\right)\end{matrix}\right.\)
⇒ nHNO3 = 4nNO + 2nNO2 + 12nN2 = 5,6 (mol)


Đặt \(n_{Al}=n_{Mg}=x\)
\(\Rightarrow27x+24x=7,65\\ \Rightarrow x=0,15\)
QT nhường e: Mg ----> Mg+2 + 2e
____________0,15_____________0,3
Al ----> Al+3 + 3e
0,15___________0,45
QT nhận e: 2N+5 + 10e ----> N2
_________________0,3______0,03
N+5 + 3e ----> N+2
______0,15_____0,05
N+5 + 8e ----> N-3
_______8a______a
\(BT\text{ }e\Rightarrow a=0,0375=n_{NH_4NO_3}\)
\(\Rightarrow m_{\text{Muối }}=m_{Al\left(NO_3\right)_3}+m_{Mg\left(NO_3\right)_2}+m_{NH_4NO_3}=57,15\left(g\right)\)