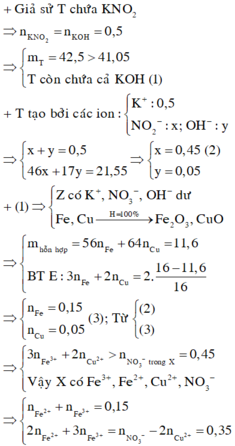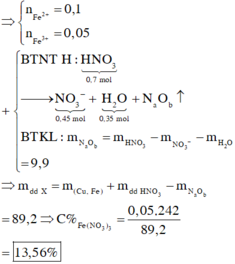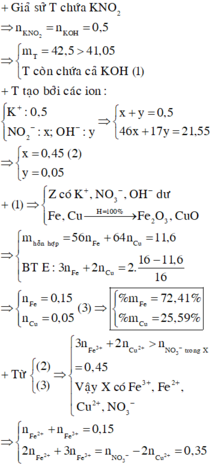Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
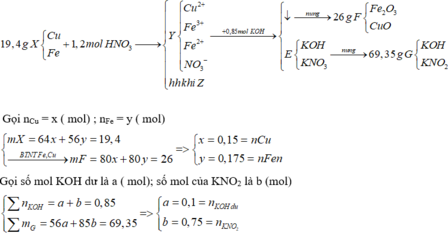
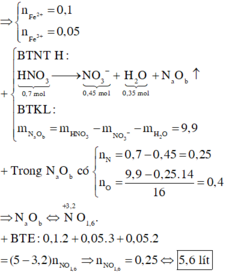
BTNT N => nN(trong Z) = nHNO3 – nNO3- = 1,2 – 0,75 = 0,45 (mol)
Ta thấy 3nFe + 2nCu = 0,875 > nNO3- = 0,75 => sản phẩm trong Y có cả Fe2+, Fe3+. HNO3 đã phản ứng hết
ne(nhường) = 3nFe3+ + 2nFe2+ + 2nCu2+ = nKOH pư = b = 0,75 (mol)
=> trung bình mỗi N+5 đã nhận 0,74/0,45 = 5/3 (electron)
=> NO2 : z ( mol) và NO: t (mol)
=> z + t = 0,45
=> Vhh Z = 0,45.22,4 = 10,08 (lít) gần nhất với 11,02 lít

Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%

Giả sử KOH không dư
⇒ nKNO2 = nKOH = 0,5 mol
⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí!. ⇒ KOH dư.
Đặt nKNO3 = x; nKOH dư = y.
Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư
⇒ 85x + 56y = 41,05
⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b
⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol.
Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol.
Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng:
mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu
⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
Đáp án B

Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
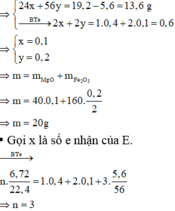
=> Khí E là NO

Đáp án B
n H N O 3 = 0,96 mol và n N a O H = 0,4 mol, n K O H = 0,2
đặt n F e = x mol và n C u = y mol
Bảo toàn nguyên tố có n F e 2 O 3 = ½ . n F e = ½ .x
n C u O = n C u = y
Ta có hệ phương trình sau 56x + 64 y = 14,8 gam và 80x + 80y = 20
→ x = 0,15 mol và y = 0,1 mol
Nếu dung dịch Z chỉ chứa 2 muối N a N O 3 và K N O 3 thì khi đun nóng thu được K N O 2 và N a N O 2
Bảo toàn nguyên tố có n N a N O 2 = n N a O H = 0,4 và n K O H = 0,2 = n K N O 2
→ mrắn = 0,4.69 +0,2. 85 = 44,6 gam > 42,86 nên Z còn chứa cả NaOH và KOH
Z chứa : N a + : 0,4 mol; K + : 0,2 mol; OH- : a mol và N O 3 - : b mol
Bảo toàn điện tích có 0,4 + 0,2 = a + b (*)
Đun nóng Z có 0,4 mol Na ; K + : 0 , 2 m o l ; O H - : a m o l v à N O 2 - : b m o l
→ 17a + 46b + 0,2.39 + 0,4.23 = 42,86 (**)
Từ (*) và (**) → a = 0,06 và b = 0,54
→ dd X chứa F e 2 + : c m o l ; F e 3 + : d m o l v à C u 2 + : 0 , 1 m o l ; N O 3 - : 0 , 54 m o l (cùng bằng lượng NO3- trong Z)
Bảo toàn điện tích có 2c + 3d + 0,1.2 = 0,54 (***)
Bảo toàn Fe có c + d =0,15 (****)
Từ (***) và (****) → c = 0,11 và d =0,04 mol
Bảo toàn nguyên tố có n N (sp khử) = n H N O 3 – n N O 3 (Y) = 0,96 – 0,54 =0,42 mol
Quy đổi khí sản phẩm khử là N : 0,42 mol và O : e mol
Bảo toàn e có 2 n F e ( 2 + ) + 3 n F e ( 3 + ) + 2 n C u ( 2 + ) - 2 n O = 5 n N
→ 5.0,42 = 2.0,11 +3.0,04 + 0,1.2 +2e
→ e = 0,78 mol
Bảo toàn khối lượng mdd X = m K L + m H N O 3 – m N – m O
= 14,8 + 126 – 0,42.14 – 0,78.16 =122,44 g
Nồng độ % của F e N O 3 3 là := 7,9%