Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeCl_2}=0,1;n_{NaCl}=0,2\)
\(\Rightarrow n_{Cl-}=0,4;n_{Fe^{2+}}=0,1\)
Cho dd \(AgNO_3\)(dư) vào dd X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn.
Chất rắn gồm: \(AgCl\left(0,4\right);Ag\left(0,1\right)\)
\(m=0,4\left(108+35,5\right)+0,1.108=68,2\\ \rightarrow A\)

Gọi x là số mol của FeCl2 (x>0) (mol)
=> Số mol NaCl là 2x (mol)
Vì khối lượng hỗn hợp là 24,4(g) nên:
mFeCl2+ mNaCl= mhh
<=> 127x+2.58,5x=24,4
<=> 127x+117x=24,4
<=> x=0,1 (Thỏa)
PTHH: FeCl2 + 2 AgNO3 -> Fe(NO3)2 + 2 AgCl
0,1________0,2____________0,1__________0,2(mol)
NaCl + AgNO3-> AgCl+ NaNO3
0,2____0,2______0,2____0,2(mol)
=> m=mAgCl= (0,2+0,2).143,5=58(g)

Gọi 3x là mol FeCl2; 2x là mol NaCl
\(\rightarrow381x+117x=24,4\)
\(\rightarrow x=0,05\)
\(\rightarrow n_{FeCl2}=0,15\left(mol\right),n_{NaCl}=0,1\left(mol\right)\)
nCl= 2nFeCl2+ nNaCl= 0,4 mol= nAgCl
\(\rightarrow m=57,4\left(g\right)\)

Chất rắn gồm : Ag,Cu dư
\(n_{Ag} = n_{AgNO_3} = 0,1(mol)\\ \Rightarrow n_{Cu} = \dfrac{15,92-0,1.108}{64} = 0,08(mol)\)
Gọi \(n_{Cu} = n_{Fe} = a(mol)\)
Dung dịch sau phản ứng :
\(Fe^{2+} : a + 0,14\\ Cu^{2+} : a - 0,08\\ NO_3^- : 0,1 + 0,14.3 = 0,52(mol)\)
Bảo toàn điện tích : 2(a+0,14) + 2(a -0,08) = 0,52
⇒ a = 0,1
Vậy \(n_{Fe^{2+}} = a + 0,14 = 0,24(mol)\)
Bảo toàn e :
\(n_{Fe^{2+}} = 3n_{NO}\\ \Rightarrow n_{NO} = \dfrac{0,24}{3} = 0,08(mol)\\ \Rightarrow V = 0,08.22,4 = 1,792(lít)\)
Đáp án C

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
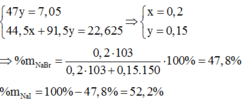
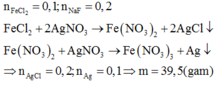






Đáp án A