Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
Bài 1 :Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu

\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
0,15<-0,3<---0,15<----0,15
a. \(M=\dfrac{8,4}{0,15}=56\left(g/mol\right)\)
Vậy M là kim loại Fe.
b. \(n_{NaOH}=0,5.1=0,5\left(mol\right)\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
0,2<-----0,2
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
0,15----->0,3
\(m_{dd.HCl}=\dfrac{\left(0,3+0,2\right).36,5.100\%}{10\%}=182,5\left(g\right)\)
\(m_{dd.A}=8,4+182,5-0,15.2=190,6\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{127.0,2.100\%}{190,6}=13,33\%\)
\(C\%_{HCl.dư}=\dfrac{0,3.36,5.100\%}{190,6}=5,75\%\)

`MO + 2HCl -> MCl_2 + H_2O`
Theo PT: `n_(MO) = (n_(HCl))/2`
`<=> 8/(M_M +16) = (0,4)/2`
`<=> M_M = 24`
`=>M` là `Mg`.
\(MO+2HCl\rightarrow MCl_2+H_2O\)
Ta có : \(n_{MO}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\)
=> \(M_{MO}=\dfrac{8}{0,2}=40\)
=> M=24 (Mg)

Số mol của khí hidro ở dktc
nH2 =\(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : X + 2HCl → XCl2 + H2\(|\)
1 2 1 1
0,1 0,1
Số mol của kim loại X
nX = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ MX = \(\dfrac{m_X}{n_X}=\dfrac{5,6}{0,1}=56\) (dvc)
Vậy kim loại x là Fe
⇒ Chọn câu : B Chúc bạn học tốt
\(R+2HCl \rightarrow RCl_2+H_2\\ n_{H_2}=\frac{2,24}{22,4}=0,1mol\\ M_R=\frac{5,6}{0,1}=56 g/mol\\ \Rightarrow R: Fe\)

2 M + 2 n H C l → 2 M C l n + n H 2
2/n <…...2 ………..mol
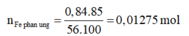
Vậy
⇒ n H 2 = n F e p ư = 0,01275 mol
⇒ V H 2 = 0,01275.22,4 = 0,2856 mol
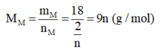
Nếu n = 1 thì M M = 9 → loại
Nếu n = 2 thì M M = 18 → loại
Nếu n = 3 thì M M = 27 → M là kim loại Al
⇒ Chọn C.

nH2=\(\frac{6,72}{22,4}=0,3\)mol
PTHH
M+2HCl--> MCl2+H2
0,3mol<---------------0,3mol
=>MM=\(\frac{19,5}{0,3}=64\)
=> km loại là kẽm (Zn)
b) nNaOH=0,2.1=0,2 mol
PTHH
NaOH+HCl-->NaCl + H2O
0,2 mol--> 0,2 mol
---> thể tích HCl 1M đã dùng là V=\(\frac{0,2+0,3}{1}=0,5\)lít
=> CM(ZnCl2)=\(\frac{0,3}{0,5}=0,6M\)

PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,04\left(mol\right)\Rightarrow m_{Zn}=0,04.65=2,6\left(g\right)\)
⇒ mCu = 9 - 2,6 = 6,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{9}.100\%\approx28,89\%\\\%m_{Cu}\approx71,11\%\end{matrix}\right.\)
\(a/\\ M+2nHCl \to MCl_n+nH_2\\ n_{H_2}=\frac{5,6}{22,4}=0,25(mol)\\ n_M=\frac{1}{n}.n_{H_2}=\frac{1}{n}.0,25=\frac{0,25}{n}(mol)\\ M_M=\frac{16,25.n}{0,25}=65.n(g/mol)\\ \text{Chạy biện luân:}\\ \Rightarrow n=1; R=65(Zn)\\ b/\\ Zn+2HCl\to ZnCl_2+H_2\\ n_{HCl}=2.n_{H_2}=2.0,25=0,5(mol)\\ V_{HCl}=\frac{0,5}{0,2}=2,5M \)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : M + 2HCl → MCl2 + H2\(|\)
1 2 1 1
0,25 0,25
a) Số mol của kim loại M
nM = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
⇒ MM = \(\dfrac{m_M}{n_M}=\dfrac{16,25}{0,25}=65\) (dvc)
Vậy kim loại M là Zn
b) Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,25 0,5
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Thể tích của dung dịch axit clohdric cần dùng
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)
Chúc bạn học tốt