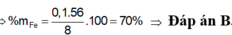Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{SO_2}=\dfrac{V_{SO_2}}{22,4}=\dfrac{2,24}{22,4}=0,1mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Cu}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=24x\\m_{Cu}=64y\end{matrix}\right.\)
\(Mg+2H_2SO_4\rightarrow MgSO_4+SO_2+2H_2O\)
x 2x x ( mol )
\(Cu+2H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
y 2x y ( mol )
Ta có:
\(\left\{{}\begin{matrix}24x+64y=4,4\\x+y=0,1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,05.24=1,2g\)
\(\Rightarrow m_{Cu}=0,05.64=3,2\)
\(m_{H_2SO_4}=n_{H_2SO_4}.M_{H_2SO_4}=\left(2.0,05+2.0,05\right).98=0,2.98=19,6g\)
À thêm đk H2SO4 đặc nóng nhá chứ H2SO4 loãng thì PTHH là:
Mg + H2SO4 -> MgSO4 + H2
Cu không tác dụng với H2SO4 loãng

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 7,8 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 2x + 3y = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{2,4}{7,8}.100\%\approx30,77\%\\\%m_{Al}\approx69,23\%\end{matrix}\right.\)
b, BTNT Mg và Al, có:
nMgCl2 = nMg = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,1.95}{0,1.95+0,2.133,5}.100\%\approx26,24\%\\\%m_{AlCl_3}\approx73,76\%\end{matrix}\right.\)
Bạn tham khảo nhé!

mO2 = 31,03% . 27,84 = 8,64 (g)
nO2 = 0,135 (mol)
nH2 = 2,24/22,4 = 0,1 (mol)
PTHH:
Al2O3 + 3H2SO4 -> Al2(SO4)3 + 3H2O (1)
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (2)
Mg + H2SO4 -> MgSO4 + H2 (3)
Theo PTHH (1): nH2O = nH2SO4 = nO = 0,135 (mol)
Theo PTHH (2)(3): nH2 = nH2SO4 = 0,1 (mol)
mH2SO4 = (0,1 + 0,135) . 98 = 5,264 (g)
mH2O = 0,135 . 18 = 2,43 (g)
mH2 = 0,1 . 2 = 0,2 (g)
Áp dụng ĐLBTKL, ta có:
mAl + mMg + mAl2O3 + mH2SO4 = m(muối) + mH2 + mH2O
=> m(muối) = 27,84 + 5,264 - 0,2 - 2,43 = 30,474 (g)

a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=5,1\) (1)
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,5\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{5,1}\cdot100\%\approx47,06\%\\\%m_{Al}=52,94\%\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,5\cdot36,5}{7,3\%}=250\left(g\right)\)
\(\Rightarrow V_{HCl}=\dfrac{250}{1,2}\approx208,33\left(ml\right)\)

\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 1a
\(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
b 1b
Gọi a là số mol của Fe
b là số mol của Mg
\(m_{Fe}+m_{Mg}=8\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Mg}.M_{Mg}=8g\)
⇒ 56a + 24b = 8g (2)
Theo phương trình : 1a + 1b = 0,2(2)
Từ (1),(2), ta có hệ phương trình :
56a + 24b = 8g
1a + 1b = 0,2
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
\(m_{Mg}=0,1.24=2,4\left(g\right)\)
0/0Fe = \(\dfrac{5,6.100}{8}=70\)0/0
0/0Mg = \(\dfrac{2,4.100}{8}=30\)0/0
Chúc bạn học tốt
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: x x
PTHH: Mg + 2HCI → MgCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}56x+24y=8\\x+y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1.56.100\%}{8}=70\%;\%m_{Mg}=100-70=30\%\)

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%