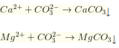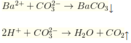Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Để nhận ra NO 3 - dùng Cu và H 2 SO 4 . Hiện tượng: Cu tan dần, dung dịch sau phản ứng có màu xanh, thoát ra khí không màu hóa nâu trong không khí.
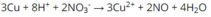

Đáp án D
Khi cho dd Na2CO3 vào dung dịch trên thì
Ca2++ CO32-→ CaCO3
Mg2+ + CO32-→ MgCO3
Ba2+ + CO32-→ BaCO3
2H++ CO32-→ CO2+ H2O
Số cation còn lại trong dung dịch là Na+, K+ và Cl-

1. 2 N H 4 + + S O 4 2 - + B a 2 + + 2 O H - → B a S O 4 ↓ + 2 N H 3 ↑ + 2 H 2 O
2. Số mol B a S O 4 : 17,475/233 = 0,075(mol)
Theo phản ứng, vì lấy dư dung dịch B a ( O H ) 2 nên S O 4 2 - chuyển hết vào kết tủa B a S O 4 và N H 4 + chuyển thành N H 3 . Do đó :
n S O 4 2 - = n B a S O 4 = 0,075 mol ;
n N H 4 + = 2. n S O 4 2 - = 2. 0,075 = 0,15 (mol).
Nồng độ mol của các ion N H 4 + và S O 4 2 - trong 75 ml dung dịch muối amoni sunfat :
[ N H 4 + ] = 2 (mol/l)
[ S O 4 2 - ] = 1 (mol/l)

Cho muối amoni tác dụng với nước vôi trong để tạo thành amoniac, cho amoniac tác dụng với clo thì sẽ thu được khí nitơ
N H 4 + + O H - → N H 3 + H 2 O
N H 3 + C l 2 → N 2 + H C l
Đáp án B

Đáp án A
Dùng dung dịch K2CO3 để loại bỏ hết tất cả các ion ![]() ra khỏi dung dịch ban đầu:
ra khỏi dung dịch ban đầu: