Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{SO_3}=\dfrac{2}{80}=0,025\left(mol\right)\\ V_{SO_3}=0,025.22,4=0,56\left(l\right)\\ m_S=0,025.32=0,8\left(g\right)\\ m_O=0,025.48=1,2\left(g\right)\\ 1nguyêntửS,3nguyêntửO\)

bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g

a)
Gọi CTHH là $Fe_xS_yO_z$
Ta có :
\(\dfrac{56x}{7}=\dfrac{32y}{6}=\dfrac{16z}{12}=\dfrac{400}{7+6+12}\)
Suy ra x = 2 ; y = 3; z = 12
Vậy CTHH là $Fe_2(SO_4)_3$ :Sắt III sunfat
b)
$n_X = \dfrac{60}{400} =0,15(mol)$
Số nguyên tử Fe = 0,15.2.6.1023 = 1,8.1023 nguyên tử
Số nguyên tử S = 0,15.3.6.1023 = 2,7.1023 nguyên tử
Số nguyên tử O = 0,15.12.6.1023 = 10,8.1023 nguyên tử

a) \(n_{N_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
b) \(n_{SO_2}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
c) \(n_{Fe}=\dfrac{3.10^{23}}{6.10^{23}}=0,5\left(mol\right)\)

a) Trong 1 mol phân tử C12H22O11 có 12 mol nguyên tử C, 22 mol nguyên tử H, 11 mol nguyên tử O. Do đó trong 1,5 mol phân tử C12H22O11 có số mol các nguyên tử của nguyên tố là:
nC = 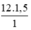 = 18 mol nguyên tử cacbon.
= 18 mol nguyên tử cacbon.
nH = 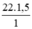 = 33 mol nguyên tử H.
= 33 mol nguyên tử H.
nO = 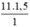 = 16,5 mol nguyên tử O.
= 16,5 mol nguyên tử O.
b) Khối lượng mol đường:
MC12H22O11 =12.MC + 22.MH + 11.MO = 12.12 + 1.22 +16.11= 342 g/mol.
c) Trong 1 mol phân tử C12H22O11 có khối lượng các nguyên tố.
mC = 12 . 12 = 144g.
mH = 1 . 22 = 22g.
mO = 16 . 11 = 176g.

\(1,+n_{fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
số nguyên tử của Fe là 0,1.6.10\(^{23}\)=0,6.10\(^{23}\)
=> số nguyên tử của Zn là 3.0,6.10\(^{23}\)=1,8.10\(^{23}\)
+ n\(_{zn}\)= \(\dfrac{1,8.10^{23}}{6.10^{23}}\)=0,3 mol
=> m \(_{Zn}\)=0,3.65=19,5g ( đpcm)

Câu a.
\(M_{Ca\left(NO_3\right)_2}=164\)g/mol
\(m_{Ca\left(NO_3\right)_2}=0,3\cdot164=49,2g\)
\(\%Ca=\dfrac{40}{164}\cdot100\%=24,39\%\)
\(m_{Ca}=\%Ca\cdot49,2=12g\)
\(\%N=\dfrac{14\cdot2}{164}\cdot100\%=17,07\%\)
\(m_N=\%N\cdot49,2=8,4g\)
\(m_O=49,2-12-8,4=28,8g\)
Các câu sau em làm tương tự nhé!

a)\(n_{Ca\left(NO_3\right)_2}=0,3mol\)
\(n_{Ca}=n_{Ca\left(NO_3\right)_2}=0,3mol\)
\(m_{Ca}=0,3\cdot40=12g\)
\(n_N=2n_{Ca\left(NO_3\right)_2}=2\cdot0,3=0,6mol\)
\(m_N=0,6\cdot14=8,4g\)
\(n_O=6n_{Ca\left(NO_3\right)_2}=6\cdot0,3=1,8mol\)
\(m_O=1,8\cdot16=28,8g\)
b)\(n_O=\dfrac{9,6}{16}=0,6mol\)
Mà \(n_O=12n_{Fe_2\left(SO_4\right)_3}\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,6}{12}=0,05mol\)
\(\Rightarrow m=20g\)
c)\(n_{CuSO_4}=\dfrac{3,2}{160}=0,02mol\)
\(n_O=4n_{CuSO_4}=0,08mol=n_{H_2}\)
\(V_{H_2}=0,08\cdot22,4=1,792l\)
a) \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\\n_O=4n_{Fe_3O_4}=0,08\left(mol\right)\end{matrix}\right.\)
b) \(n_{N_2O}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_N=2n_{N_2O}=0,3\left(mol\right)\\n_O=n_{N_2O}=0,15\left(mol\right)\end{matrix}\right.\)
c) Ta có: \(n_{H_2SO_4}=\dfrac{4,9}{98}=0,05\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_H=2n_{H_2SO_4}=0,1\left(mol\right)\\n_S=n_{H_2SO_4}=0,05\left(mol\right)\\n_O=4n_{H_2SO_4}=0,2\left(mol\right)\end{matrix}\right.\)