Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(\left\{{}\begin{matrix}\%Fe=\dfrac{56.2}{160}.100\%=70\%\\\%O=100\%-70\%=30\%\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}\%Al=\dfrac{27.2}{342}.100\%=15,79\%\\\%S=\dfrac{32.3}{342}.100\%=28,07\%\\\%O=\dfrac{16.12}{342}.100\%=56,14\%\end{matrix}\right.\)

\(a,\%Cu=\dfrac{m_{Cu}}{M_{CuSO_4}}=\dfrac{64}{160}=40\%\\ \%S=\dfrac{m_S}{M_{CuSO_4}}=\dfrac{32}{160}=20\%\\ \%O=100\%-\%Cu-\%S=100\%-40\%-20\%=40\%\)
\(b,\%Fe=\dfrac{m_{Fe}}{M_{Fe_3O_4}}=\dfrac{168}{232}=72,41\%\\ \%O=100\%-\%Fe=100\%-72,41\%=27,59\%\)
\(c,\%Fe=\dfrac{m_{Fe}}{M_{FeO}}=\dfrac{56}{72}=77,77\%\\ \%O=100\%-\%Fe=100\%-77,77\%=22,23\%\)
\(d,\%K=\dfrac{m_K}{M_{K_2SO_3}}=\dfrac{78}{138}=56,52\%\\ \%C=\dfrac{m_C}{M_{K_2SO_4}}=\dfrac{12}{138}=8,69\%\\ \%O=100\%-\%K-\%C=100\%-56,52\%-8,69\%=34,79\%\)

\(\%Fe=\dfrac{56}{56.2+16.3}.100\%=35\%\\ \%O=\dfrac{16}{56.2+16.3}.100\%=10\%\)

\(M_{Fe_2O_3}=56\cdot2+16\cdot3=160\left(đvc\right)\)
\(\%m_{Fe}=\dfrac{112}{160}\cdot100\%=70\%\)
\(\%m_O=\dfrac{48}{160}\cdot100\%=30\%\)
\(\left\{{}\begin{matrix}\%Fe=\dfrac{56.2}{56.2+16.3}.100\%=70\%\\\%O=100\%-70\%=30\%\end{matrix}\right.\)

\(M_{Fe_3O_4}=56.3+16.4=232\left(\dfrac{g}{mol}\right)\)
\(\%Fe=\dfrac{56.3}{232}.100\%=72,4\%\)
\(\%O=\dfrac{16.4}{232}.100\%=27,862\%\)
tìm công thức hóa học của hợp chất có thàn phần các nguyên tố như sau:55,189%K; 14,623%P và còn lại là oxi.Biết 0,05 mol hợp chất có khối lượng là 10,6 gam

a) Với Fe3O4 thì Fe là 72,4% và O là 27,6%;
Với Fe2O3 thì Fe là 70% và O là 30%
b) Với SO2 thì S là 50% và O là 50%
Với SO3 thì S là 40% và O là 60%
c) mCu= \(\dfrac{80.80}{100}\)=64(g) ; mO=\(\dfrac{80.20}{100}\)=16(g)
nCu=\(\dfrac{64}{64}\)=1(mol) ; nO=\(\dfrac{16}{16}\)=1(mol)
Vậy CTHH của oxit đồng màu đen là: CuO
d) dA/H2=\(\dfrac{Ma}{2}\)=17 => MA=2.17=34(đvC)
H =\(\dfrac{5,88.34}{100}\)\(\approx\)2(đvC) ; S =\(\dfrac{94,12.34}{100}\)\(\approx\)32
=> CTHH của chất khí A là SH2

Câu 1 :
\(M_{K_2CO_3}=39.2+12+16.3=138\left(dvC\right)\)
\(\%K=\dfrac{39.2}{138}.100\%=56,52\%\)
\(\%C=\dfrac{12}{138}.100\%=8,69\%\)
\(\%O=100\%-56,52\%-8,69\%=34,79\%\)
Còn lại cậu làm tương tự nhá

\(CaCO_3\\ \%m_{Ca}=\dfrac{40}{40+12+3.16}.100=40\%\\ \%m_C=\dfrac{12}{40+12+16.3}.100=12\%\\ \Rightarrow\%m_O=100\%-\left(40\%+12\%\right)=48\%\\ H_2SO_4\\ \%m_H=\dfrac{2.1}{2.1+32+4.16}.100\approx2,041\%\\ \%m_S=\dfrac{32}{2.1+32+4.16}.100\approx32,653\%\\ \%m_O=\dfrac{4.16}{2.1+32+4.16}.100\approx65,306\%\\ Fe_2O_3\\ \%m_{Fe}=\dfrac{56.2}{56.2+16.3}.100=70\%\\ \Rightarrow\%m_O=100\%-70\%=30\%\)
CaCO3
\(\%M_{\dfrac{Ca}{CaCO_3}}=\dfrac{40}{100}.100\%=40\%\)
\(\%M_{\dfrac{C}{CaCO_3}}=\dfrac{12}{100}.100\%=12\%\)
\(\%M_{\dfrac{O}{CaCO_3}}=100\%-\left(40\%+12\%\right)=48\%\)
H2SO4
\(\%M_{\dfrac{H_2}{H_2SO_4}}=\dfrac{2}{98}.100\%=2,04\%\)
\(\%M_{\dfrac{S}{H_2SO_4}}=\dfrac{32}{98}.100\%=32,65\%\)
\(\%M_{\dfrac{O}{H_2SO_4}}=100\%-\left(2,04\%+32,65\%\right)=65,31\%\)
Fe2O3
\(\%M_{\dfrac{Fe}{Fe_2O_3}}=\dfrac{112}{160}.100\%=70\%\)
\(\%M_{\dfrac{O}{Fe_2O_3}}=100\%-70\%=30\%\)
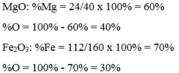
Khối lượng mol của \(Fe2O3\) là :
\(M_{Fe_2}_{O_3}=56,2+16,3=160\left(g.mol\right)\)
\(\%Fe=\dfrac{56.2}{100}.100\%=70\%\)
\(\%O=100\%-70\%=30\%\)
MFe\(_2O_3\) = 56.2+16.3 = 160 ( g/mol )
\(\%Fe=\dfrac{56.2}{160}.100\%=70\%\)
\(\Rightarrow\%O=100\%-70\%=30\%\)