Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

dA/kk = 0,552 ⇒ Khối lượng mol của khí A: 29.0,552 = 16 (g)
Đặt CTHH của khí A là CxHy
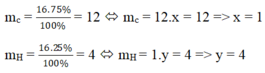
Công thức hóa học của khí A là: CH4
PTPỨ:

Tỉ lệ số mol cũng chính là tỉ lệ thể tích.
Theo phương trình nO2 = 2.nCH4 ⇒ VO2 = 2.VCH4 = 2.11,2 = 22,4(l)

\(n_A=\dfrac{V\left(đktc\right)}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(d_{\dfrac{A}{kk}}=\dfrac{M_A}{M_{kk}}=\dfrac{M_A}{29}=0,552\)
⇒ \(M_A=16\) g/mol
Khối lượng của từng nguyên tố trong 1 mol khí A:
\(\left\{{}\begin{matrix}m_C=\dfrac{16.75}{100}=12g\\m_H=\dfrac{16.25}{100}=4g\end{matrix}\right.\)
Số mol của từng nguyên tố trong 1 mol khí A:
\(\left\{{}\begin{matrix}n_C=\dfrac{12}{12}=1mol\\n_H=\dfrac{4}{1}=4mol\end{matrix}\right.\)
⇒ \(CTHH:CH_4\)

Gọi CTPT của A là CxHy.
Ta có: \(\dfrac{m_C}{m_H}=\dfrac{75\%}{25\%}\Rightarrow\dfrac{12n_C}{n_H}=\dfrac{75\%}{25\%}\Rightarrow\dfrac{n_C}{n_H}=\dfrac{1}{4}\)
⇒ x:y = 1:4
→ A có CTPT dạng (CH4)n
Mà: \(M_A=8.2=16\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{16}{12+4}=1\)
→ CTPT của A là CH4.
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}=1\left(mol\right)\)
\(\Rightarrow V_{O_2}=1.22,4=22,4\left(l\right)\)
\(\Rightarrow V_{kk}=5V_{O_2}=112\left(l\right)\)

\(M_A =29.0,552 = 16(đvC)\)
Số nguyên tử C = \(\dfrac{16.75\%}{12} = 1\)
Số nguyên tử H = \(\dfrac{16.25\%}{1} = 4\)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\)
Theo PTHH :
\(V_{O_2} = 2V_{CH_4} = 11,2.2 = 22,4(lít)\)

Vì A có tỉ khối với không khí là 0,552
=> MA = 0,552 x 29 = 16 (g/mol)
Gọi công thức của A là CxHy
=> mC = \(\frac{16.75}{100}=12\left(gam\right)\)
=> nC = 12 / 12 = 1 (mol)
=> mH = 16 - 12 = 4 (gam)
=> nH = 4 / 1 = 4 (mol)
=> x : y = 1 : 4
=> Công thức hóa học của A: CH4

a) \(n_{O_2}=\dfrac{11,2.20\%}{22,4}=0,1\left(mol\right)\)
PTHH: 2Mg + O2 --to--> 2MgO
0,2<--0,1--------->0,2
=> mMg = 0,2.24 = 4,8 (g)
b) nMgO = 0,2.40 = 8 (g)

nA = \(\dfrac{11,2}{22,4}\) = 0,5 mol
d \(\dfrac{A}{kk}\) = \(\dfrac{MA}{29}\) = 0,552 \(\Rightarrow\) MA = 29 . 0,552 = 16 (g/mol)
- nC = \(\dfrac{75.16}{100.12}\) = 1 mol
- nH = \(\dfrac{25.16}{100.1}\) = 4 mol
A là CH4
PT : CH4 + O2 -> CO2 + 2H2O
nO2 = 2nCH4 = 2.0,5 = 1 mol
VO2 = 1. 22,4 = 22,4 l
Khối lượng mol khí A tham gia phản ứng là:
dA/kk = 0,552 => MA = 29 . 0,552 = 16 g
mC = = 12; mH =
= 4
Đặt công thức hóa học của khí A là CxHy, ta có:
12 . x = 12 => x = 1
1 . y = 4 => y = 4
Công thức hóa học của khí A là CH4
Phương trình phản ứng
CH4 + 2O2 → CO2 + 2H2O
Theo phương trình phản ứng, thể tích oxi bằng hai lần thể tích khí CH4 nên thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A là:
= 2 .
= 11,2 . 2 = 22,4 lít

\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5mol\)
PTHH:
\(2Mg+O_2->2MgO\)
2 : 1 : 2 mol
1 : 0,5 : 1 mol
\(m_{Mg}=n.M=1.24=24g\)
\(m_{MgO}=n.M=1.\left(24+16\right)=40g\)
nO2 = 11,2/22,4 = 0,5 (mol)
PTHH: 2Mg + O2 -> (t°) 2MgO
Mol: 1 <--- 0,5 ---> 1
mMg = 1 . 24 = 24 (g)
mMgO = 1 . 40 = 40 (g)

a)
\(n_P = \dfrac{62}{31} = 2(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ n_{O_2} = \dfrac{5}{4}n_P = 2,5(mol)\\ V_{O_2} = 2,5.22,4 = 56(lít)\\ V_{không\ khí} = \dfrac{56}{20\%} = 280(lít)\)
b)
\(n_P = \dfrac{31}{31} = 1(mol) ; n_{O_2} = \dfrac{23}{32} = 0,71875(mol)\\ \dfrac{n_P}{4} = 0,25 > \dfrac{n_{O_2}}{5} = 0,14375 \to P\ dư\\ n_{P\ pư} = \dfrac{4}{5}n_{O_2} = 0,575(mol)\\ m_{P\ dư} = 31 - 0,575.31 = 13,175(gam)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,2875(mol) \Rightarrow m_{P_2O_5} = 0,2875.142=40,825(gam)\)
Ta có: \(M_A=0,552.29=16\)
Gọi CTTQ của A là \(C_xH_y\) (với x;y thuộc N*)
Ta có: \(x:y=\dfrac{\%m_C}{M_C}:\dfrac{\%m_H}{M_H}=\dfrac{75\%}{12}:\dfrac{25\%}{1}=0,0625:0,25=1:4\)
Suy ra CTDGN của A là \(\left(CH_4\right)_n\)
Mặt khác \(16.n=16\Rightarrow n=1\)
Vậy A là CH4
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=2.\dfrac{11,2}{22,4}=1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=22,4\left(l\right)\)