
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Câu 3:
\(a,n_{Fe}=x(mol);n_{Zn}=y(mol)\\ \Rightarrow 56x+65y=18,6(1)\\ n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow x+y=0,3(2)\\ (1)(2)\Rightarrow x=0,1;y=0,2\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{18,6}.100\%=30,11\%\\ \Rightarrow \%_{Zn}=100\%-30,11\%=69,89\%\)
\(b,\Sigma n_{H_2SO_4}=x+y=0,3(mol)\\ \Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,3}{0,1}=3M\\ c,n_{ZnSO_4}=0,2(mol);n_{FeSO_4}=0,1(mol)\\ \Rightarrow m_{ZnSO_4}=0,2.161=32,2(g)\\ m_{FeSO_4}=0,1.152=15,2(g)\)


Câu 1 :
Gọi $m_{dd} = a(gam)$
$n_{NaOH} = \dfrac{a.20\%}{40} = 0,005a(mol)$
$n_{Ba(OH)_2} = \dfrac{a.8,55\%}{171} = 0,0005a(mol)$
$n_{HNO_3} = \dfrac{224}{1,1.1000}.4,5 = 0,9(mol)$
$NaOH + HNO_3 \to NaNO_3 + H_2O$
$Ba(OH)_2 + 2HNO_3 \to Ba(NO_3)_2 + 2H_2O$
Theo PTHH :
$0,005a + 0,0005a.2 = 0,9 \Rightarrow a = 150(gam)$
Câu 2 :
Gọi thể tích dung dịch cần tìm là V(lít)
$n_{H_2SO_4} = 1,1V(mol) ; n_{HCl} = 1,98V(mol)$
$\Rightarrow n_H = 1,1V.2 + 1,98V = 4,18V(mol)$
$n_{NaOH} = 0,19.3 = 0,57(mol) ; n_{Ba(OH)_2} = 0,19.4 = 0,76(mol)$
$\Rightarrow n_{OH} = 0,57 + 0,76.2 = 2,09(mol)$
$H + OH \to H_2O$
$\Rightarrow 4,18V = 2,09 \Rightarrow V = 0,5(lít)$


\(a.n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.0,1........0,2..........0,1.........0,1\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,1.98}{140}.100=7\%\\ c.m_{dd.muối}=6,5+140-0,1.2=146,3\left(g\right)\\ C\%_{ddZnCl_2}=\dfrac{136.0,1}{146,3}.100\approx9,296\%\\ \)
a.nZn=6,565=0,1(mol)Zn+2HCl→ZnCl2+H2b.0,1........0,2..........0,1.........0,1(mol)C%ddH2SO4=0,1.98140.100=7%c.mdd.muối=6,5+140−0,1.2=146,3(g)C%ddZnCl2=136.0,1146,3.100≈9,296%


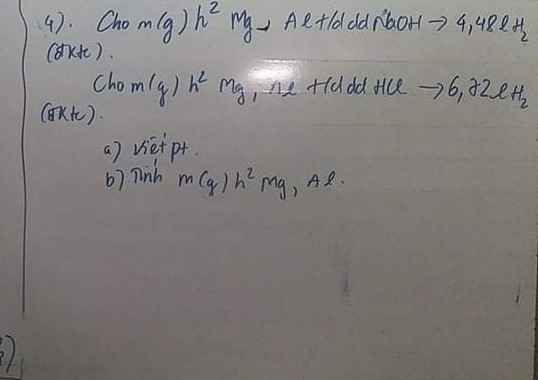






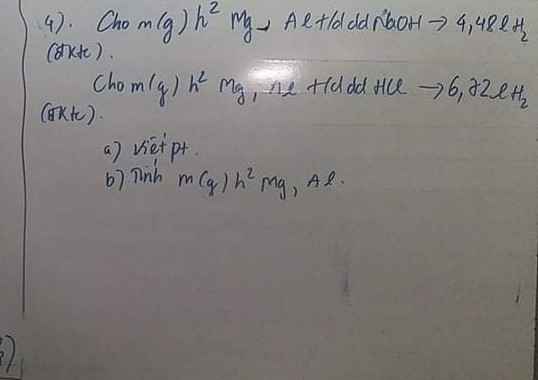
Bài 2:
Gọi x,y lần lượt là KL dung dịch NaOH 10% và KL dd NaOH 20% (x,y>0)
=> (1) : x+y=400
Mặt khác, KL chất tan của NaOH tổng là : 400.16%=64(g)
=> (2) 0,1x+0,2y=64
Từ (1), (2) ta có hpt:
\(\left\{{}\begin{matrix}x+y=400\\0,1x+0,2y=64\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=160\\y=240\end{matrix}\right.\)
=> Cần 160 gam dung dịch NaOH 10% và 240 gam dung dịch NaOH 20% để tạo ra 400 gam dung dịch NaOH 16%.
Chúc em học tốt!
Bài 4:
nH2SO4(2M)= 0,3(mol)
VddH2SO4(5M)= 200/1,29=20000/129(ml)=20/129(l)
=>nH2SO4(5M)= 5. 20/129=100/129(mol)
=> \(CMddH2SO4\left(mới\right)=\dfrac{0,3+\dfrac{100}{129}}{0,15+\dfrac{20}{129}}\approx3,525\left(M\right)\)