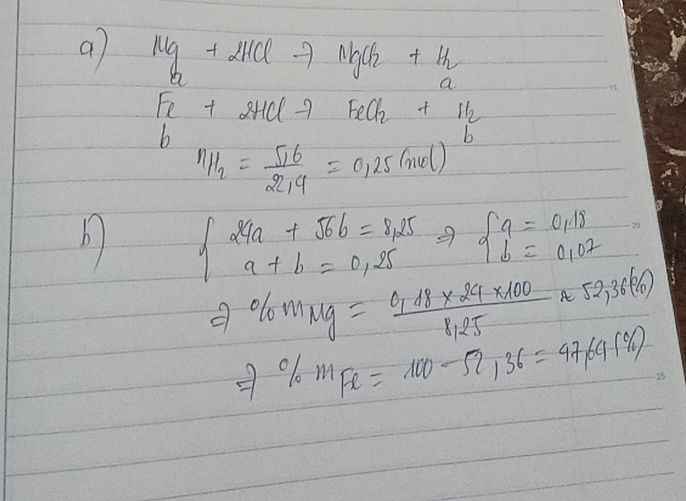Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1C
2C
3A
4B
5A
6 Không nhìn ra số gì hết
7Không nhìn ra số gì hết
8B

\(n_{Na_2SO_3}=\dfrac{18,9}{126}=0,15\left(mol\right)\)
\(n_{NaOH}=1.0,4=0,4\left(mol\right)\)
PTHH:
2NaOH + SO2 ---> Na2SO3 + H2O
0,3 0,15 0,15
=> \(n_{NaOH\left(tạo.muối.axit\right)}\) = 0,4 - 0,3 = 0,1 (mol)
NaOH + SO2 ---> NaHSO3
0,1 0,1
\(\rightarrow V_{SO_2}=\left(0,1+0,15\right).22,4=5,6\left(l\right)\)


a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=22,8\) (1)
Ta có: \(n_{SO_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,7\cdot2=1,4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,3\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,25\cdot24}{22,8}\cdot100\%\approx26,32\%\\\%m_{Fe}=73,68\%\end{matrix}\right.\)
b) PTHH: \(2NaOH+H_2SO_{4\left(dư\right)}\rightarrow Na_2SO_4+2H_2O\)
Theo PTHH: \(n_{H_2SO_4\left(dư\right)}=\dfrac{1}{2}n_{NaOH}=\dfrac{0,4\cdot3}{2}=0,6\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,15\left(mol\right)\\n_{MgSO_4}=n_{Mg}=0,25\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{H_2SO_4\left(p/ứ\right)}=n_{MgSO_4}+3n_{Fe_2\left(SO_4\right)_3}+n_{SO_2}=1,4\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4}=1,4+0,6=2\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{2\cdot98}{98\%}=200\left(g\right)\)

Câu 1 :
\(2KMnO_4+16HCl_{\left(đ\right)}\underrightarrow{^{t^0}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(H_2+Cl_2\underrightarrow{^{as}}2HCl\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Câu 2 :
\(n_{Mg}=a\left(mol\right),n_{Zn}=b\left(mol\right)\)
\(m_{hh}=24a+65b=14.55\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=a+b=0.35\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.15\)
\(\%m_{Mg}=\dfrac{0.2\cdot24}{14.55}\cdot100\%=33.98\%\)
\(\%m_{Zn}=100-33.98=67.01\%\)


nKMnO4 = 14,2/158 ≃ 0,0899 mol
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,0899 \(\dfrac{0,0899\times5}{2}\)
→ nCl2 = 0,22475 mol → VCl2 = 22,4.nCl2 = 5,0344 lít