Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
mNaOH = v.d.C% = 31,25.1,12.16% = 5,6 (gam)
Þ nNaOH = 0,14
Các phản ứng xảy ra theo thứ tự:
2NaOH + H2SO4 g Na2SO4 + 2H2O
Cu(NO3)2 + 2NaOH g Cu(OH)2¯ + 2NaNO3
Cu(OH)2 g CuO + H2O
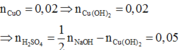
Do đó trong 50ml dung dịch B chứa 0,05 mol H2SO4 và 0,02 mol Cu(NO3)2 .
Khi cho 50ml dung dịch B tác dụng với 0,0375 mol Cu thì:
3Cu+4H2SO4+Cu(NO3)2g4CuSO4+2NO+4H2O
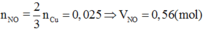

Đáp án B
mNaOH = v.d.C% = 31,25.1,12.16% = 5,6 (gam)
Þ nNaOH = 0,14
Các phản ứng xảy ra theo thứ tự:
2NaOH + H2SO4 g Na2SO4 + 2H2O
Cu(NO3)2 + 2NaOH g Cu(OH)2¯ + 2NaNO3
Cu(OH)2 g CuO + H2O
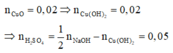
Do đó trong 50ml dung dịch B chứa 0,05 mol H2SO4 và 0,02 mol Cu(NO3)2 .
Khi cho 50ml dung dịch B tác dụng với 0,0375 mol Cu thì:
3Cu+4H2SO4+Cu(NO3)2g4CuSO4+2NO+4H2O
Do đó
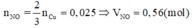

Mg+2HCl->MgCl2+H2
x------2x--------x---------x
2Al+6HCl->2AlCl3+3H2
y---------3y-----y--------3\2y
ta có :
\(\left\{{}\begin{matrix}24x+27y=11,7\\x+\dfrac{3}{2}y=0,6\end{matrix}\right.\)
=>x=0,15 mol, y=0,3 mol
=>%mMg=\(\dfrac{0,15.24}{11,7}.100=30,77\%\)
=>%mAl=100-30,77=69,23%
b)
m HCl=1,2.36,5=43,8g
=>C%=\(\dfrac{43,8}{200}.100\)=21,9%

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=20\) (1)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{MgCl_2}+2n_{FeCl_2}=2n_{Mg}+2n_{Fe}=2a+2b\)
\(\Rightarrow2a+2b=0,5\cdot2\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,25\end{matrix}\right.\)
+) Trong không khí
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,125\left(mol\right)\\n_{MgO}=n_{Mg}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_1=0,125\cdot160+0,25\cdot40=30\left(g\right)\)
+) Trong chân không
Bảo toàn nguyên tố: \(n_{FeO}=n_{Fe}=n_{Mg}=n_{MgO}=0,25\left(mol\right)\)
\(\Rightarrow m_2=0,25\cdot72+0,25\cdot40=28\left(g\right)\)

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
Ta có: \(\left\{{}\begin{matrix}\Sigma n_{HCl}=0,4\cdot2=0,8\left(mol\right)\\n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,1mol\\n_{Al_2O_3}=0,1mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al_2O_3}=0,1\cdot102=10,2\left(g\right)\\m_{Mg}=0,1\cdot24=2,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{hh}=10,2+2,4=12,6\left(g\right)\)
Theo PTHH: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,1mol\\n_{AlCl_3}=2n_{Al_2O_3}=0,2mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{MgCl_2}=0,1\cdot95=9,5\left(g\right)\\m_{AlCl_3}=0,2\cdot133,5=26,7\left(g\right)\end{matrix}\right.\)
Mặt khác: \(\left\{{}\begin{matrix}m_{ddHCl}=400\cdot1,2=480\left(g\right)\\m_{H_2}=0,1\cdot2=0,2\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=492,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{9,5}{492,4}\cdot100\%\approx1,93\%\\C\%_{AlCl_3}=\dfrac{26,7}{492,4}\cdot100\%\approx5,42\%\end{matrix}\right.\)
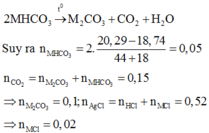


câu này bạn lấy ở đâu mà khó quá!