Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có OH- 0,06 mol và H+ có 0,05 mol
=> Sau khi trộn còn dư 0,01 mol OH- và V = 1 lít
=> pH = 12
=> Đáp án B

Chọn C
Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 ⇒ y = 0,04
Khi trộn dung dịch X và Y thì H+ + OH- → H2O
(0,04) (0,03)
⇒ nH+còn dư = 0,04 – 0,03 = 0,01 mol ⇒ [H+] còn dư = 0,01/0,1 = 0,1M ⇒ pH = – lg[H+] = 1

Chọn D
Vì: Bảo toàn điện tích với dd X ta có:
0,17. 1 = 0,02.1 + 2nBa2+
=> nBa2+ = 0,075 (mol)
Bảo toàn điện tích với dd Y ta có:
2.0,03 + 1.nHCO3- = 0,1.1
=> nHCO3- = 0,04 (mol)
Trộn dd X với Y xảy ra phản ứng:
OH- + HCO3- → CO32- + H2O
0,04 →0,04 → 0,04 (mol)
Ba2+ + CO32- → BaCO3↓
0,07 ←( 0,03+ 0,04) → 0,07 (mol)
=> m↓ = mBaCO3 = 0,07.197= 13,79 (g)

Đáp án : A
Bảo toàn điện tích : nH+ + 3nAl3+ = nNO3- + 2nSO4 => 3a – b = -0,06
, nOH = nKOH + 2nBa(OH)2 = 0,168 mol ; nBa2+ = 0,012 mol
, mkết tủa = mBaSO4 + mAl(OH)3 => nAl(OH)3 = 0,012 mol < 1/3( nOH – nH+)
=> Có hiện tượng kết tủa tan 1 phần => nAl(OH)3 = 4nAl3+ - (nOH- - nH+)
=> nAl3+ = a = 0,02 => b = 0,12

Đáp án C
+ N a + : 0 , 12 N H 4 + : 0 , 05 C l - : 0 , 12 S O 4 2 - : x = 0 , 025 ⏟ d u n g d ị c h X + B a 2 + : 0 , 03 O H - : 0 , 06 l → B a S O 4 : 0 , 025 N H 3 : 0 , 05 + N a + : 0 , 12 l C l - : 0 , 12 B a 2 + : 0 , 005 O H - : 0 , 01 ⏟ d u n g d ị c h Y + Y → c ô c ạ n m c h ấ t r ắ n = m i o n = 7 , 875 g a m

Đáp án A
Theo BTĐT: x = (0,12 + 0,05 – 0,12) : 2 = 0,025 mol.
Cho 0,03 mol Ba(OH)2 phản ứng với ddX
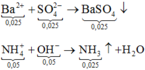
Vậy khi phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được ddY gồm 0,12 mol Na+; 0,12 mol Cl−; 0,005 mol Ba2+; 0,01 mol OH−
Vậy m = 0,12x23 + 0,12x35,5 + 0,005x137 + 0,01x17 = 7,875 gam


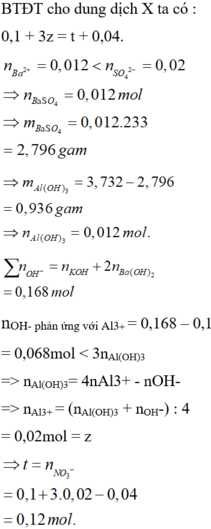
A
Dung dịch X. Số mol (SO4)2- = 0,03 mol.
Từ pH = 2 ta tính được số mol H+ = 5. 10-3 mol.
Vậy số mol H+ trong dung dịch Y là : 0,01 + 5. 10-3 = 0,015 mol
Số mol của Ba2+ = 2,5.10-3 mol.
Ba2+ + SO42- ® BaSO4
Vậy khối lượng kết tủa: m = 2,5.10-3.233 = 0,5825 gam.