Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C.
Từ tỉ lệ nAl: nFe3O4 = 4 : 1 => Đặt nAl = 4x và nFe3O4 = x => 27×4x + 232x = 20,4 => x = 0,06
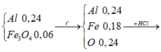

Đặt nNO = x => nHCl dư trong Y = 4x
nHCl phản ứng = 2×0,24 + 2×0,34 = 1,16 => nAgCl = 1,16 + 4x
BTE => 0,24×3 + 0,06 = 2×0,34 + 3x + nAg => nAg = 0,1 - 3x
=> 184,51 = 143,5×(l,16 + 4x) + 108×(0,l - 3x) =>x = 0,029
Vậy V = 1000×0,029×22,4 = 649,6.

Sau phản ứng có Al dư do phản ứng với NaOH tạo H2
=> nAl dư = 2/3 .nH2 = 0,02 mol
Sau phản ứng có Al và Al2O3 + NaOH => NaAlO2
Bảo toàn Al ta có :
2nAl2O3 sau nung= nAl dư + 2nAl2O3 => nAl2O3 = 0,04 mol
=>nAl ban đầu = 0,1 mol
Do các phản ứng hàn toàn , mà khi nhiệt nhôm Al dư => oxit sắt hết
=>D chỉ có Fe
=>Bảo toàn e : 3nFe = 2nSO2 => nFe = 0,08 mol
Bảo toàn khối lượng : mA = mB = mFe + mAl + mAl2O3 = 9,1g
=>%mAl(A) = 29,67% gần nhất với giá trị 24%
=>A



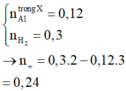
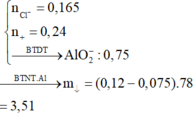
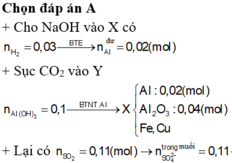




Chọn B.