Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mddH3PO4= 500(g)
=>mH3PO4=500.24,5=122,5(g)
=>nH3PO4=1,25(mol)
PTHH: 4P +5 O2 -to-> 2 P2O5
P2O5 +3 H2O -> 2 H3PO4
nP2O5=1,25/2=0,625(mol)
=>nP=1,25(mol)
=>a=mP=1,25.31=38,75(g)
Chúc em học tốt!
\(n_{H_3PO_4}=\dfrac{500.1.24,5\%}{98}=1,25\left(mol\right)\)
Bảo toàn nguyên tố P : \(n_P=n_{H_3PO_4}=1,25\left(mol\right)\)
=> \(m_P=1,25.31=38,75\left(g\right)\)

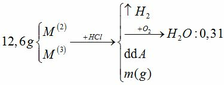
Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
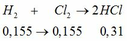
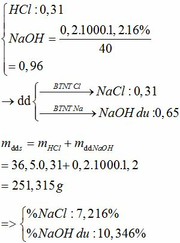

a) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3\cdot98}{20\%}=147\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{147}{1,14}\approx128,95\left(ml\right)\)
b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)=n_{FeSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\V_{H_2}=0,3\cdot24,76=7,428\left(l\right)\\m_{FeSO_4}=0,3\cdot152=45,6\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddH_2SO_4}-m_{H_2}=163,2\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{45,6}{163,2}\cdot100\%\approx27,94\%\)

a, Dung dịch K chứa CuCl2 → có màu xanh lá cây.
b, Ta có: \(m_{ddHCl}=1,1.100=110\left(g\right)\Rightarrow m_{HCl}=110.20,4\%=22,44\left(g\right)\)
\(\Rightarrow n_{HCl}=\dfrac{22,44}{36,5}\approx0,6\left(mol\right)\)
PT: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
____0,3_____0,6_____0,3 (mol)
⇒ x = mCuO = 0,3.80 = 24 (g)
c, Ta có: m dd sau pư = 24 + 110 = 134 (g)
\(\Rightarrow C\%_{CuCl_2}=\dfrac{0,3.135}{134}.100\%\approx30,22\%\)
d, Có: nCuCl2.2H2O = nCuCl2 = 0,3 (mol)
mCuCl2.2H2O = 0,3.171 = 51,3 (g)
\(\Rightarrow\%m_{H_2O\left(trongL\right)}=\dfrac{0,3.2.18}{51,3}.100\%\approx21,05\%\)
Bạn tham khảo nhé!

PT: \(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
\(AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\)
Ta có: \(n_{AgNO_3}=0,1.0,6=0,06\left(mol\right)\)
Theo PT: \(n_{Al}=n_{AlCl_3}=\dfrac{1}{3}n_{AgNO_3}=0,02\left(mol\right)\)
⇒ m = mAl = 0,02.27 = 0,54 (g)
\(C_{M_{AlCl_3}}=\dfrac{0,02}{0,15}=\dfrac{2}{15}\left(M\right)\)

a) \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,1 0,075 0,05
\(V_{O_2}=0,075.22,4=1,68\left(l\right)\)
b) \(m_{Al_2O_3}=0,05.102=5,1\left(g\right)\)
c)
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Mol: 0,05 0,3 0,1
\(m_{ddHCl}=\dfrac{0,3.36,5.100}{7,3}=150\left(g\right)\)

\(BTNT\left(S\right):n_{SO3}=n_{SO2}=\dfrac{V}{22,4}=\dfrac{5}{14}\left(mol\right)\)
Ta có : \(n_{H2SO4}=\dfrac{9}{25}\left(mol\right)\)
\(\Rightarrow\Sigma n_{H2SO4}=\dfrac{5}{14}+\dfrac{9}{25}=\dfrac{251}{350}\left(mol\right)\)
\(\Rightarrow C\%=\dfrac{m_{H2SO4}}{m_{dd}}.100\%=64,7\%\)
4P + 5O2 = 2P2O5 (1)
P2O5 + 3H2O = 2H3PO4 (2)
ta có: mddH3PO4= v.D= 500.0,1= 50g
mH3PO4 = C%.mdd:100= 24,5%.50:100= 12,25g
nH3PO4= \(\dfrac{m}{M}\) = 12,25:98=0,125mol
thế vào ptr 2 tính được số mol P2O5=0,125.\(\dfrac{1}{2}\)=0,0625mol
thế số mol của P2O5 vào ptr 1 ta tính được số mol P=0,0625.4:2=0,125mol
mP= n.M= 0,125.31= 3,875g hay a= 3,875g
dong thu 3 hinh nhu sai . mk KO hieu . Ai giai thck gium mk vs