Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{6,75}{18}=0,75\left(mol\right)\)
\(n_O=\dfrac{5,75-\left(0,25.12+0,75.1\right)}{16}=0,125\left(mol\right)\)
\(\%C=\dfrac{0,25.12}{5,75}.100=52,17\%\)
\(\%H=\dfrac{0,75.1}{5,75}.100=13,04\%\)
\(\%O=100-52,17-12,04=34,79\%\)
Đặt CTTQ X: CxHyOz
\(x:y:z=0,25:0,75:0,125=2:6:1\)
CTĐG X: \(\left(C_2H_6O\right)_n\)
\(M_X=23.2=46\) \((g/mol)\)
\(\Leftrightarrow46n=46\)
\(\Leftrightarrow n=1\)
`->` CTPT X: C2H6O

Câu 8:
a, \(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)=n_C\) \(\Rightarrow\%C=\dfrac{0,25.12}{5,75}.100\%\approx52,17\%\)
\(n_{H_2O}=\dfrac{6,75}{18}=0,375\left(mol\right)\Rightarrow n_H=0,375.2=0,75\left(mol\right)\)
\(\Rightarrow\%H=\dfrac{0,75.1}{5,75}.100\approx13,04\%\)
\(\Rightarrow\%O=100-13,04-52,17=34,79\%\)
b, Gọi CTPT của X là CxHyOz.
\(\Rightarrow x:y:z=\dfrac{52,17}{12}:\dfrac{13,04}{1}:\dfrac{34,79}{16}=2:6:1\)
→ CTPT của X có dạng là (C2H6O)n
Mà: MX = 23.2 = 46 (g/mol)
\(\Rightarrow n=\dfrac{46}{12.2+1.6+16}=1\)
Vậy: CTPT của X là C2H6O.
trên thực tế nếu làm tròn đến số thập phân thứ 2 cho mỗi %
%O chỉ = 34,78%

n CO2=11,0/44=0,25(mol)
=>n(C)=0,25mol
mC=0,25*12=3(g)
n H2O=6,75/18=0,375(mol)
=>nH=0,75(mol)
=>mH=0,75(g)
nO=2/16=0,125(mol)
CTPT là CxHyOz
x:y:z=0,25:0,75:0,125=2:6:1
=>C2H6O là CTĐGN
=>CTPT là \(C_{2x}H_{6x}O_x\)
Theo đề, ta có: 24x+6x+16x=46
=>x=1
=>C2H6O

3. Đốt cháy hoàn toàn 5,75 gam hợp chất hữu cơ X (chứa C, H, O) thu được 11,0 gam CO và 6,75 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong X.
b) Lập công thức đơn giản nhất của X.
c) Tìm công thức phân tử của X. Biết tỉ khối hơi của X so với khí hiđro bằng 23
------------------------------------------------------------------
\(a,n_{CO_2}=\frac{11}{44}=0,25mol\)
\(n_{H_2O}=\frac{6,75}{18}=0,375mol\)
Bảo toàn khối lượng ta có:
\(m_{O_2}=12g\Rightarrow n_{O_2}=0,375mol\)
Bảo toàn \(O\)
\(n_O\) trong \(X=0,125mol\)
\(\%m_C=0,25.\frac{12}{5,75}.100\%=52,17\%\)
\(\%m_H=\frac{0,75}{5,75}.100\%=13,04\%\)
\(\%m_O=34,79\%\)
\(n_C:n_H:n_O=0,25:0,75:0,125=2:6:1\)
\(\Rightarrow CT\) đơn giản nhất là \(C_2H_6O\)\(M_X=23.2=46\)
Ta có \(:46n=46\Rightarrow n=1\)
Vậy \(CTPT\) của \(X\) là \(C_2H_6O\)
1. Phân tích một hợp chất hữu cơ thấy: Cứ 2,1 phần khối lượng cacbon lại có 2,8 phần khối lượng oxi và 0,35 phần khối lượng hidro. Hãy xác định công thức phân tử chất hữu cơ, biết rằng 1g chất hữu cơ đó ở (đktc) chiếm thể tích 373,3cm3.
_____________________________
Giải
Ta có :
\(C:H:O=\frac{2,1}{12}:\frac{0,35}{1}:\frac{2,8}{16}\)
\(\rightarrow0,175:0,35:0,175\)
\(=1:2:1\)
\(M=\frac{1}{0,3733:22,4}=60\)
\(\rightarrow CTPT:C_2H_4O_2\)

+nC(CO2) = n CO2 = 11:44 = 0,25 (mol)
+n H(H2O) = 2nH2O = 2. (6,75/18)= 0,75 (mol)
=> mC + mH = 0,25 . 12 + 0,75 . 1 = 3 + 0,75 = 3,75 (g) < 5 ,75
+ nO = 2 / 16 = 0,125 (mol)
=> nC : nH : nO = 0,25 : 0,75 :0,125 = 2:6:1
=> CT nguyên : (C2H6O)n
lại có : Mx/MH2 = 23 => Mx = 23 .2 = 46 (g/mol)
=> 46 . n = 46
=> n = 46
Vậy CTPT của X là C2H6O

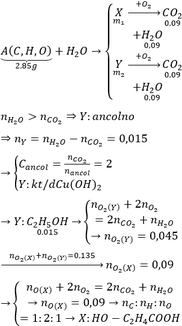
Nhận thấy: Đốt cháy A và đốt cháy Y cần thể tích khí O2 là như nhau. Ta có
BTNT C: nCO2 = nCO2 + nNa2CO3 = 0,4
BTKL: mA + mO2 = mCO2 + mH2O
=> mH2O = 7,2g

a) MX = 146g/mol
VCO2 : VH2O = 6 : 5
=> nC : nH = 3 : 5
=> CTĐGN: (C3H5Oa)n
→ (41 + 16a).n = 146 → (a; n) = (4; 2) → X: C6H10O4
b) C6H10O4 + 6,5O2 → 6CO2 + 5H2O
0,05 0,325
=> p = 7,3g
c)
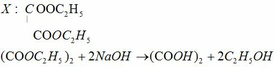
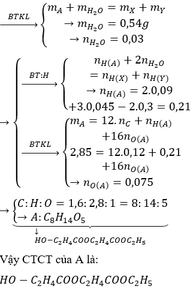
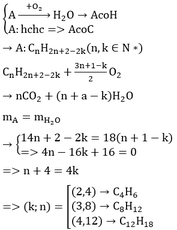
a)\(m_C=\frac{11.12}{44}=3\left(g\right)\)
\(m_H=\frac{6,75.2}{18}=0,75\left(g\right)\)
\(\Rightarrow m_O=5,75-3-0,75=2\left(g\right)\)
\(\Rightarrow\%C=\frac{3}{5,75}.100=52,17\%\)
\(\%H=\frac{0,75}{5,75}.100=13,04\%\)
\(\Rightarrow\%O=100-52,17-13,04=34,79\%\)
b)\(n_C=\frac{3}{12}=0,25\left(mol\right);n_H=\frac{0,75}{1}=0,75\left(mol\right);n_O=\frac{2}{16}=0,125\left(mol\right)\)Gọi CT tổng quát của X là CxHyOz (x,y,z \(\in N\)*)
Ta có x:y:z=0,25:0:75:0,125=2:6:1
Vậy CTTQ của X là (C2H6O)n
c)Ta có tỉ khối hơi của X so với khí hiđro bằng 23
=>MX=23MH2=46(đvC)
=> (C2H6O)n=46
=>n=1
Vậy CTPT của X là C2H6O (C2H5OH)
Tại sao mC lại 11.12/44 ?