

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án D
- Xét trường hợp dung dịch Y chứa 2 chất tan là NaOH và NaCl. Quá trình điện phân diễn ra như sau :
Tại catot:
Fe2+ + 2e → Fe
x ← 2x → x
2H2O + 2e → 2OH- + H2
2y → 2y y
Tại Anot:
2Cl- → Cl2 + 2e
(2x + 2y) (x + y) ← (2x + 2y)
- Từ phương trình: Al + 3H2O + NaOH -> Na[Al(OH)4] + 1,5H2 suy ra nOH = nAl = 0,02 => y = 0,01 mol
- Khối lượng dung dịch giảm: 56x + 71nCl2 + 2nH2 = 4,54 => x = 0,03 mol
- Hỗn hợp X: 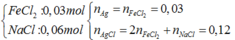 => m = 20,46g
=> m = 20,46g

Đáp án D
Xét trường hợp dung dịch Y chứa 2 chất tan là NaOH và NaCl . Quá trình điện phân diễn ra như sau


Đáp án C
Dung dịch Y chứa 2 chất tan nên CuSO4 và NaCl bị điện phân hết. Các ptpt xảy ra:
Cu2+ + 2Cl- à Cu+ Cl2 (1)
2CuSO4 + 2H2O à 2Cu + 2H2SO4 + O2 (2)
2Al + 3H2SO4 à Al2(SO4)3 + 3H2 (3)
Theo các ptpu (3) và (2) thì số mol H2SO4 = số mol CuSO4 = 1,5 nAl = 0,2 (mol)
Theo (1) và giả thiết ta có số mol CuSO4 = 0,3 (mol); số mol NaCl = 0,2 (mol)
Giả sử trong quá trình điện phân H2O chưa bị điện phân thì khối lượng dung dịch giảm = 29,5 < 33,1
Vậy nước bị điện phân; khối lượng nước bị điện phân = 3,6 (gam)
ne trao đổi = 2nCl2 + 4nO2 = 1 (mol)
→ t = n F 3600 . 1 = 5 , 36 (giờ)

Đáp án : B
Gọi số mol CuSO4 và NaCl lần lượt là 2x và 5x mol
Chất tan trong dung dịch chắc chắn có Na2SO4
Vì dung dịch Y phản ứng với Al tạo khí
mà nCl > 2nCu
=> chắc chắn chất còn lại là NaOH
=> Cu2+ và Cl- bị điện phân hết
Các quá trình có thể xảy ra
Catot :
Cu2+ + 2e -> Cu
2H2O + 2e -> H2 + 2OH-
Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
n O H = 2 / 3 n H 2 = 0 , 1 m o l
Vì sau khi điện phân sau các quá trình trên chỉ là điện phân H2O
-> H2 và O2 không ảnh hưởng đến các ion trong dung dịch
=> nOH + 2nCu = nCl
=> 0,1 + 4x = 5x
=> x = 0,1 mol
m g i ả m = m C u + m C l 2 + m H 2 + m H 2 O
⇒ n H 2 O đ p s a u = 0 , 1 m o l
⇒ n e t r a o đ ổ i = 0 , 7 m o l
=> t = 9,72h