Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
* t giây: n khí(anot) > 0,5nKCl => H2O bị điện phân
nCl2 = 0,5nKCl = 0,0375 mol
nO2 = 0,05-0,0375 = 0,0125 mol
n e(1) = 2nCl2 + 4nO2 = 0,0375.2 + 0,0125.4 = 0,125 mol
* 2t giây: n e(2) = 2ne(1) = 0,25 mol
n khí = 2,38/22,4 = 0,10625 mol
Catot:
Cu2+ +2e → Cu
a….....2a
H2O + 1e → OH- + 0,5H2
0,05← 0,025
Anot:
Cl- - 1e → 0,5Cl2
0,075..0,075..0,0375
H2O -2e → 2H+ + 0,5O2
0,175 0,04375
=> 2a + 0,05 = 0,25 => a = 0,1 mol

Đáp án C
CuSO4 : a mol
KCl : 0,2 mol
n khí (+) = 2,464 : 22,4 = 0,11 mol (t giây)
Dung dịch điện phân có Cu2+, Cl- nên giai đoạn đầu điện phân H2O chưa bị điện phân.
Tại cực (+) 2Cl− →Cl2 + 2e
0,2 →0,1 0,2 mol
nCl2 = 0,1 < 0,11
Vậy trong thời gian t giây ở (+), H2O đã bị điện phân.
2H2O → O2 + 4e + 4H+
0,01 →0,04
⇒nO2 = 0,11−0,1=0,01 mol
Ta có n e- nhường trong t (giây) = 0,2 + 0,04 = 0,24 mol
Vậy trong thời gian 2t (giây) ne- (nhường, nhận) = 0,24 × 2 = 0,48 mol
⇒ trong t (giây) kế tiếp ở (+) H2O đã điện phân tiếp.
2H2O→O2 + 4e + 4H+
0,06← 0,24
⇒ n khí (+) = 0,1 + 0,01 + 0,06 = 0,17 mol
∑n(↑) ở 2 cực trong 2t (giây) = 5,824 : 22,4= 0,26 mol
⇒ ở cực (-) Cu2+ đã hết và H2O đã bị khử thoát H2.
⇒nH2 = 0,26−0,17 = 0,09 mol⇒nH2 = 0,26−0,17 = 0,09 mol
(−)Cu+2 + 2e →Cu
a→ 2a
2H2O + 2e → H2 + 2OH−
0,18←0,09
Ta có: 2a + 0,18 = 0,48 ⇔ 2a = 0,03 ⇒ a = 0,15

Đáp án D
n k h i ( 1 ) = 3 , 696 22 , 4 = 0 , 165 ( m o l ) ; n k h i ( 2 ) = 8 , 736 22 , 4 = 0 , 39 ( m o l )
Trong t giây, tại catot thu được 0,165 (mol) => gồm nCl2 = 0,15 (mol) và nO2 = 0,015 (mol)
Tại catot Tại anot
Cu2+ +2e → Cu 2Cl-→ Cl2 + 2e
0,3 → 0,15 (mol)
2H2O → O2 + 4H+ + 4e
0,015 →0,06 (mol)
=> trong t (s) số mol e trao đổi = 0,3 + 0,06 = 0,36 (mol)
Trong thời gian 2t giây, số mol e trao đổi = 0,36.2 = 0,72 (mol)
=> Tại anot thu thêm một lượng khí O2 là: n O 2 = n e 4 = 0 , 36 4 = 0 , 09 ( m o l )
=> nH2 (anot) = 0,39 – nCl2- nO2 = 0,39 – 0,15 – (0,06 + 0,09) = 0,09 (mol)
Bảo toàn electron ta có: ne(nhận) = 2nCu2+ + 2nH2 = 0,72
=> nCu2+ = (0,72 – 0,09.2 )/2 = 0,27 (mol)
=> a = 0,27 (mol)

Đáp án A
* t giây:
- Tại anot: nkhí (0,0825) > n c l 2 m a x (0,075) ⇒ H 2 O bị điện phân ở anot
Cl- - 1e ® 0,5Cl2
0,15 0,15 0,075
H2O - 2e ® 2H+ + 0,5O2
0,03 ¬ 0,0075
Þ ne = 0,18 mol
* 2t giây: ne = 0,36 mol, nkhí = 0,195 mol
| Catot |
Anot |
| Cu2+ + 2e ® Cu x 2x H2O + 1e ® 0,5H2 + OH- 0,135 ¬ 0,0675 |
Cl- - 1e ® 0,5Cl2 0,15 0,15 0,075 H2O – 2e ® 2H+ + 0,5O2 0,21 0,0525 |
Þ 2x + 0,135 = 0,36 Þ x = 0,1125
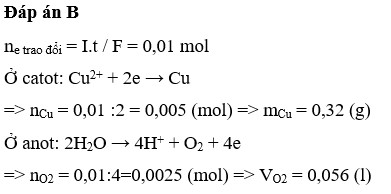



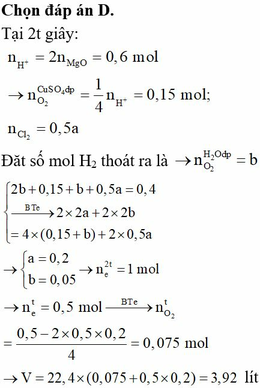

Đáp án B.