Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
I = 2,68 A; t = 6h ; nKhí = 4,48/22,4 = 0,2 (mol)
![]()
Tại catot xảy ra quá trình oxi hóa Cu2+ Tại anot xảy ra quá trình oxi hóa Cl-, H2O
Cu2+ +2e → Cu 2Cl- → Cl2 + 2e
a → 0,5a → 2a (mol)
2H2O → O2 + 4H+ + 4e
b → 0,5b → 2b → 2b (mol)
Vì dung dịch sau phản ứng tác dụng được với Fe và rắn thu được gồm 2 kim loại => Cu2+ còn dư sau quá trình điện phân. Và có khí NO thoát ra => tại anot H2O bị điện phân để sinh ra H+
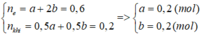
=> nH+ = 2b = 0,4 (mol)
Vì Fe dư sau phản ứng nên Fe chỉ lên số oxi hóa +2; gọi số mol Cu2+ dư là x (mol)
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,15 ← 0,4 (mol)
Fe + Cu2+ → Fe2+ + Cu↓
x ← x → x (mol)
Khối lượng kim loại giảm: ∆ giảm = mFe phản ứng – mCu sinh ra
=> (20 – 12,4) = 0,15 + x).56 – 64x
=> x = 0,1 (mol)
=> nCu2+ bđ = nCu2+ đp + nCu2+ dư = 0,6/2 + 0,1 = 0,4 (mol)
=> m = mCu(NO3)2 + mNaCl = 0,4. 188 + 0,2. 58,5 = 86,9 (g)

Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b => a + b = 0,12
Bảo toàn e: n e = 2a + 4b
Lúc 2t giây: n e = 4a + 8b
Lúc này ở anot thu được Cl2 a mol và O2
Do vậy ở catot thu được là H2 với số mol H2
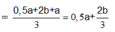
Bảo toàn e: n C u 2 +
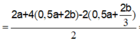
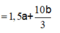
![]()
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.

Đáp án A
Số mol khí thoát ra bằng 0 , 336 22 , 4 = 0,015 (mol) nên số mol e trao đổi bằng 0,015.4 = 0,06 (mol)
Đặt n Ag 2 SO 4 = x ( mol ) n CuSO 4 = y ( mol )
Cu2+ + 2e ⟶ Cu
y ⟶ 2y ⟶ y
Ag+ + e ⟶ Ag
2x ⟶ 2x ⟶ 2x
Khối lượng catot tăng thêm chính là tổng khối lượng Ag và Cu nên có hệ:
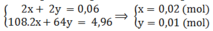
Khối lượng kim loại bám ở catot lần lượt là: 0,02.2.108 = 4,32 (g) và 0,01.64 = 0,64 (g).


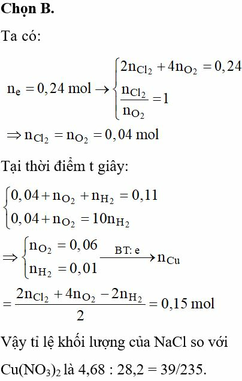

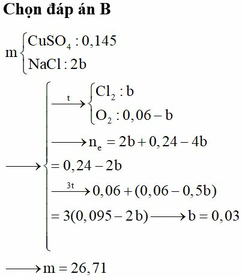


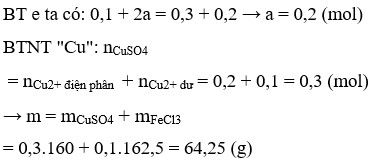
Đáp án C.
=> m = 1,92 gam