Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Điện phân trong 3378 giây tương đương với số e trao đổi là 0,07 mol
Do trao đổi 0,07 mol e chỉ thu được thêm 0,025 mol Cu, chứng tỏ Cu hết
Lúc này ở catot thu thêm 0,025 mol Cu và 0,01 mol H2
Vậy lúc này ở anot thu được thêm 0,025 mol khí
Do số mol khí trao đổi 0,07 nên chứng tỏ đã có tạo ra O2.
Vậy ở anot thu được Cl2 và O2 với số mol lần lượt là 0,015 và 0,01 mol.
Mặt khác do lúc t giây chỉ thu được Cu ở catot và Cl2 ở anot nên a=b.
Vậy t giây thì n e = 2 a nên 2t giây thì n e = 4 a
Lúc 2t giây ở anot thu được a+0,025 mol Cu và a-0,025 mol H2.
Ở catot thu được a+0,015 mol Cl2 và O2 0,5a-0,0075 mol
Tổng số mol khí thu được là:
a - 0,025 +a + 0,015 + 0,5a - 0,0075 = 2,0625a
Giải được a= 0,04
Vậy số mol CuSO4 là 0,065 mol và KCl là 0,11 mol
=> m = 18,595 gam

Chọn A
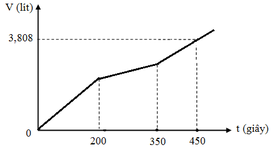
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol → BT : e nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol → BT : e n H 2 = 0 , 5 x
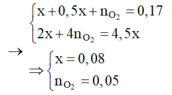
Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ
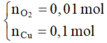
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mAl tăng
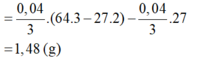

Chọn A.
Tại t1 = 965s
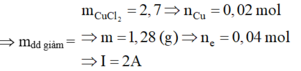
Tại t2 = 3860s Þ ne = 0,16 mol Þ có khí Cl2 (x mol) và O2 (y mol).
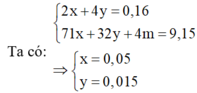
Tại t3 (s) Þ 5m = 6,4 = mCu Þ Ở catot có khí H2 (a mol) và ở anot có khí Cl2 (0,05 mol); O2 (b mol)
mà mdd giảm = 11,11 = 6,4 + 0,05.71 + 2a + 32b (1) và 2a + 0,1.2 = 4b + 0,05.2 (2)
Giải hệ (1), (2) suy ra: a = 0,02 ; b = 0,035 Þ ne = 0,24 mol Þ t3 = 11580s. Vậy t3 : t1 = 12.

Chọn C
Do tại 3 thời điểm khối lượng catot đều tăng nên Cu2+ điệp phân chưa hết ở t1 và t2
∙Tại t1 = 1930 giây: ne1 = It1/F = 0,02I
=> nCl2 = 0,01I
n e1 = 2nCu2+ bị đp => 0,02I = 2m/64 1
m dung dịch giảm = mCu + mCl2 => 2,7 = m + 71.0,01I 2
Giải 1 và 2 => m = 1,28; I = 2
∙Tại t2 = 7720 => ne2 = 0,16 mol
Anot:
Cl- -1e → 0,5Cl2
x 0,5x
H2O -2e → 0,5O2 + 2H+
y 0,25y
x+y = 0,16
0,5x.71+0,25y.32+4.1,28 = 9,15
Giải ra ta được x = 0,1; y = 0,06
∙Tại t3 = t: Giả sử nước bị điện phân ở cả 2 điện cực
nH2 = a mol, nO2 = b mol
m dung dịch giảm = mCu + mH2 + mCl2 +mO2 => 11,11 = 5.1,28 + 2a + 0,05.71 + 32b 3
n e anot = ne catot => 2nCu + 2nH2 = 2nCl2 + 4nO2 => 2.0,1 + 2a = 0,05.2 + 4b 4
Giải 3 và 4 thu được: a = 0,02; b = 0,035
n e3 = 2.0,1 + 2.0,02 = 0,24 mol => t = 0,24.96500/2 = 11580 giây

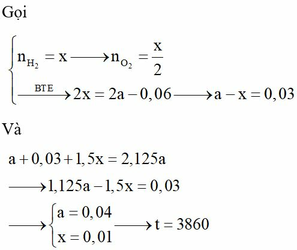







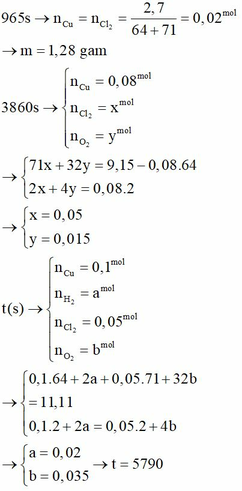
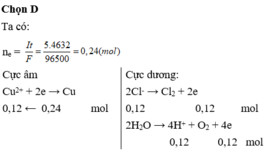

Đáp án A
Gọi số mol e lúc t giây là x.
Túc t giây thu được a mol khí ở 2 điện cực và b mol Cu.
Lúc t+2895s thì số mol e là x+0,06 mol thì thu được a+0,03 mol khí và b+0,02 mol Cu.
Ta có: 0,02. 2 < 0,06
chứng tỏ lúc này Cu2+ hết ở catot thu được thêm 0,02 mol Cu và 0,01 mol H2.
Vậy ở anot thu được 0,02 mol khí do vậy khí này gồm cả Cl2 và O2, giải được số mol Cl2 và O2 đều là 0,01 mol.
Vậy lúc t giây thu được số mol Cu là 0,5x=b và khí chỉ là Cl20,5x=a.
Lúc 2t giây thu được 2,125a mol khí và a+0,02 mol Cu.
Số mol e lúc này là 2x.
Ở catot thu được số mol H2 là
Ở anot thu được Cl2 là 0,5x +0,01 mol và O2
Giải được: x=0,08.
Vậy dung dịch ban đầu chứa CuSO4 0,06 mol và NaCl 0,1 mol.
Dừng điện phân ở thời điểm 5404 giây tức số mol e là 0,112 mol.
Ở catot thu được Cu: 0,056 mol.
Ở anot thu được Cl2 0,05 mol và O2 0,003 mol.
Do vậy dung dịch sau điện phân chứa Cu2+ dư 0,004 mol, H+ 0,012 mol, Na+ và SO42-.
Khi cho thanh Fe vào thì khối lượng thanh Fe giảm đi