

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
Ta có:

![]()
Ta có quá trình xảy ra tại các điện cực:
Catot Anot
![]()
![]()
0,08 → 0,16 0,01 → 0,04
Nhận thấy: ![]() chưa điện phân hết
chưa điện phân hết
Bảo toàn electron ta có: n C u = 1 2 n e n h ậ n = 0 , 02 m o l → m c a t o t t ă n g = m C u = 0 , 02 . 64 = 1 , 28 g

Đáp án C
Tại thời gian 3088 thì n e = x suy ra tại 6176 là 2x.
Do khối lượng catot tăng tỉ lệ theo thời gian nên lúc 6176s thì Cu2+ chưa bị điện phân hết.
Tại thời gian 6176 khối lượng dung dịch giảm không tăng theo tỉ lệ theo thời gian nên lúc này Cl- đã bị điện phân hết và có sinh khí O2
Tại 3088s:
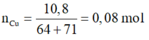
Tại 6176s ta thu được ở catot là 0,16 mol Cu, ở anot là khí Cl2 và O2.
Giải được số mol Cl2 và O2 là 0,1 và 0,03 mol.
Tại t giây ở ta thu được 0,2 mol Cu, 0,1 mol Cl2, O2 và H2 có thể có.
Bảo toàn e và khối lượng dung dịch giảm giải được số mol O2 và H2 là 0,065 và 0,03 mol
![]()

Đáp án A
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e
0,36 ←0,18 2x x 2x
2H2O + 2e → 2OH- + H2. 2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)