Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
mO = 26,8.47,76% = 12,8g => nO = 0,8 => nSO42- = 0,2 => mSO42- = 19,2g => mkim loại = 26,8 – 19,2 = 7,6g
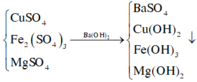
m = mBaSO4 + mCu(OH)2 + mFe(OH)3 + mMg(OH)2 = mBaSO4 + mkim loại + mOH-
Lưu ý: nOH- = 2nSO42- = 0,4 => m = 0,2.233 + 7,6 + 0,4.17 = 6

Đáp án C:
nelectrontraođổi ![]()
Rắn X là Ag; khí Z là O2.
Dung dịch Y gồm HNO3 và AgNO3 dư. (Y phản ứng với Fe thu hỗn hợp kim loại)
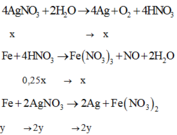
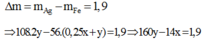
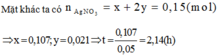

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

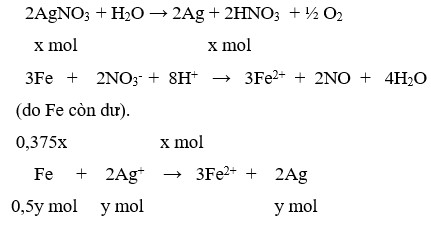
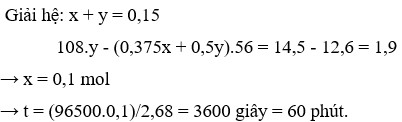
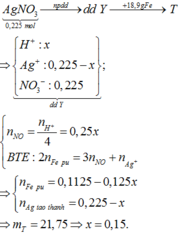

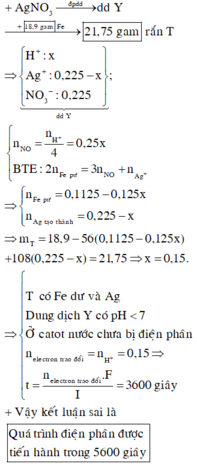


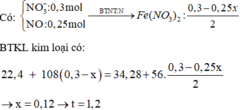
Đáp án C
Phản ứng điện phân:
Vì khi cho sắt vào dung dịch Y, kết thúc phản ứng thu được hỗn hợp kim loại nên hỗn hợp này gồm Ag và Fe dư.
Do đó dung dịch thu được chỉ chứa cation Fe2+ và AgNO3 chưa bị điện phân hết.
Gọi n A g N O 3 b ị đ i ệ n p h â n = x thì n A g N O 3 c h ư a b ị đ i ệ n p h â n = 0,15 - x
Dung dịch Y chứa x mol HNO3 và (0,15 - x)mol AgNO3
Áp dụng định luật bảo toàn mol electron, ta có:
Áp dụng định luật bảo toàn khối lượng ta có: