Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

n SO2 = 0,25 mol
QT oxi hóa QT khử Al(0) -----> Al(+3) + 3e S(+6) + 2e --------> S(+4)mol x -----> 3x mol 0,5 <--------- 0,25 Cu(0) -------> Cu(+2) + 2emol y --------> 2y Theo bảo toàn e n (e nhường) = n (e nhận) <--> 3x + 2y = 0,5 (1)bảo toàn khối lượng 27x + 64y = 9,1 (2)Từ (1) và (2) ta có hpt\(\begin{cases}2x+3y=0,5\\27x+64y=9,1\end{cases}\)\(\Rightarrow\begin{cases}x=0,1\\y=0,1\end{cases}\)---> m al = 0,1*27=2,7 gam ---> %m al = (2,7 : 9,1)*100=29,6%----> %m cu = 100 - 29,6=70,4%
Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%

Đáp án A
→ n SO 4 2 - ( muoi ) = n SO 2 = 0 , 045
→ m muoi = 1 , 68 + 0 , 045 . 96 = 6
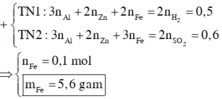
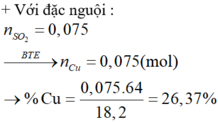



chịu