Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Áp dụng định luật bảo toàn điện tích: tổng số mol điện tích dương bằng tổng số mol điện tích âm
nên a+ 2b= c+ 2d

Áp dụng định luật bảo toàn điện tích: tổng số mol điện tích dương bằng tổng số mol điện tích âm
nên 2.0,05+ 0,15.1= 0,1.1+ 2x → x= 0,075 mol

Đáp án C
Nhận thấy Mg2+ và H+ không thể tồn tại cùng với CO32-
→Dung dịch A chứa K+, NH4+, CO32- và ion âm An-
Theo định luật bảo toàn điện tích: 0,15+ 0,25=0,15.2+ n.nAn-
→ n.nAn-= 0,1 mol → Anion còn lại trong dung dịch A là Cl-
→Dung dịch A chứa K+, NH4+, CO32- và Cl-
→mchất rắn khan= 0,15.39 + 0,25.18+ 0,15.60 + 0,1.35,5= 22,9 gam
Dung dịch B chứa H+, Mg2+, SO42- và NO3-
Chú ý khi cô cạn thì axit HNO3 (0,2 mol) sẽ bay hơi cùng nước
→mchất rắn khan= mMg2++ mSO4(2-)+ mNO3- dư
= 0,1.24+ 96.0,075+ 0,05.62=12,7 gam

Đáp án A
Ba2++ SO42- → BaSO4
nSO4(2-) = nBaSO4 = 34,95/233=0,15 mol = nBa2+
Theo ĐLBT ĐT thì a+2b = c suy ra a+2.0,15 = c nên c-a = 0,3
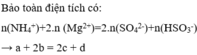
Đáp án B
Bảo toàn điện tích a + 3b +2c = x +2y