Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Số mol NaHCO3 là: n NaHCO 3 = 0 , 004 mol
Phương trình hoá học:
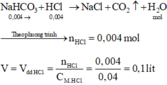

Dùng natri hidrocacbonat \(\left(NaHCO_3\right)\)
Do natri hidrocacbonat tác dụng với axit trong dạ dày tạo thành muối, khí và nước => làm hết lượng axit trong dạ dày làm hết đau dạ dày
\(NaHCO_3+HCl\rightarrow NaCl+CO_2\uparrow+H_2O\)

Người ta thường dùng thuốc muối (NaHCO3) để làm giảm cơn đau dạ dày vì trong dạ dày chứa hydrochloric acid (HCl). Khi nồng độ acid này tăng cao ta sẽ bị đau dạ dày. Thuốc muối chứa NaHCO3 sẽ phản ứng với HCl giúp giảm nồng độ HCl trong dạ dày.
NaHCO3 + HCl → NaCl + H2O + CO2

Câu 1:
Người bị đau dạ dày thường uống thuốc có chứa thành phần NaHCO3, vì nó sẽ làm giảm lượng axit clohidric trong dạ dày
PTHH: \(NaHCO_3+HCl\rightarrow NaCl+CO_2\uparrow+H_2O\)

A : KMnO4
B : K2MnO4
C : MnO2
D : O2
E : HCl :
F : MnCl2
G : Cl2
H : KCl
I : KOH
L : H2
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$MnO_2 + 4HCl \xrightarrow{t^o} MnCl_2 + Cl_2 + 2H_2O$
$2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O$
$2KCl + 2H_2O \xrightarrow{đpdd,cmn} 2KOH + H_2 + Cl_2$
$H_2 + Cl_2 \xrightarrow{as} 2HCl$

\(2Al+6HCl->2AlCl_3+3H_2\\ Fe+2HCl->FeCl_2+H_2\\ n_{Al}=a;n_{Fe}=b\\ 27a+56b=8,3\\ 1,5a+b=\dfrac{5,6}{22,4}=0,25\\ a=b=0,1\\ m_{Al}=27\cdot0,1=2,7g\\ m_{Fe}=8,3-2,7=5,6g\\ a=\dfrac{3a+2b}{500}\cdot36,5=3,65\%\\ m_{ddsau}=508,3-0,25\cdot2=507,8g\\ C\%_{AlCl_3}=\dfrac{133,5a}{507,8}=2,63\%\\ C\%_{FeCl_2}=\dfrac{127b}{507,8}=2,50\%\)