Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Áp suất tăng 3 lần, nhiệt độ không đổi thì thể tích giảm 3 lần nên nồng độ tăng 3 lần
Vậy tốc độ phản ứng tăng: 3.3.3 = 27 (lần)

Tốc độ tức thời của phản ứng:
\(v=k\left[NO\right]^2.\left[O_2\right]\)
a,
Khi tăng nồng độ NO lên gấp đôi:
\(v=k\left(2\left[NO\right]\right)^2.\left[O_2\right]=4k\left[NO\right]^2.\left[O_2\right]\)
Vậy tốc độ tăng gấp 4 lần
b,
Khi thể tích giảm 1 nửa, nồng độ mỗi chất tăng gấp đôi:
\(v=k\left(2\left[NO\right]\right)^2.2\left[O_2\right]=8k\left[NO\right]^2.\left[O_2\right]\)
Vậy tốc độ tăng gấp 8 lần
c,
Độ tăng nhiệt:
\(\Delta t^o=1900-400=1500\)
Với mỗi lần tăng nhiệt độ 150oC, tốc độ tăng 3 lần.
Vậy khi tăng nhiệt độ 10 lần như vậy, tốc độ tăng 310 = 59049 lần

Đáp án A
Tốc độ phản ứng tức thời: v = k[SO2]2.[O2]
Vậy tốc độ phản ứng tăng lên 4 lần khi tăng nồng độ SO2 lên 2 lần.

Đáp án A
Tốc độ phản ứng tức thời: v = k[SO2]2.[O2]
Vậy tốc độ phản ứng tăng lên 4 lần khi tăng nồng độ SO2 lên 2 lần.

Đáp án A
2+ 1 > 2
Khi tăng áp suất, cân bằng sẽ chuyển dịch theo theo chiều làm giảm tác động của việc tăng áp suất đó nên cân bằng sẽ chuyển dịch theo chiều thuận
Chọn A

Đáp án B
Theo định nghĩa, số lần tăng tốc độ phản ứng khi nhiệt độ thay đổi 100C chính là hệ số nhiệt độ γ.
Suy ra γ = 3.
Gọi nhiệt độ sau khi tăng là t2
Thay vào công thức ta có
81 = 3 ( 1 - 30 ) / 10 ⇔ ( t 2 - 30 ) 10 = 4 ⇔ t 2 = 70 0 C

Đáp án B
Theo định nghĩa, số lần tăng tốc độ phản ứng khi nhiệt độ thay đổi 100C chính là hệ số nhiệt độ γ.
Suy ra γ = 3.
Gọi nhiệt độ sau khi tăng là t2
Thay vào công thức ta có
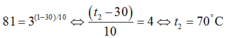

Tất cả các phản ứng đều là tỏa nhiệt nên muốn cân bằng chuyển dịch theo chiều thuận thì phải giảm nhiệt độ, nên tăng nhiệt độ sẽ ko có phản ứng nào. Do đó, chọn D

Đề có cho đáp án không bạn nhỉ?