Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhiệt độ sôi của các dẫn xuất halogen tăng dần theo chiều tăng độ dài mạch carbon (cùng loại halogen) và tăng dần theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl)

Theo nguyên tử khối của Halogen, ta sẽ có: \(M_F< M_{Cl}< M_{Br}< M_I\)
Do đó: Nhiệt độ sôi tương ứng của chúng sẽ tăng dần
=> Nhiệt độ sôi của CH3F, CH3Cl, CH3Br, CH3I lần lượt là -78 độ C, -24 độ C, 4 độ C và 24 độ C

- Trạng thái: Formaldehyde và acetaldehyde là những chất khí ở nhiệt độ thường; các hợp chất carbonyl khác là chất lỏng hoặc rắn.
- Nhiệt độ sôi của các hợp chất carbonyl nhìn chung cũng tăng theo chiều tăng dần số nguyên tử carbon. Độ tan của các hợp chất carbonyl giảm dần theo chiều tăng dần của số nguyên tử carbon.

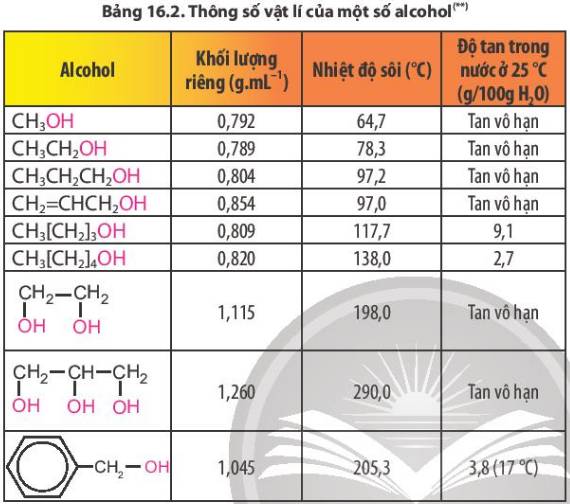
-> Hầu như các alcohol tan vô hạn trong nước.
-> Số lượng C tăng, thì độ tan và nhiệt độ sôi giảm dần.
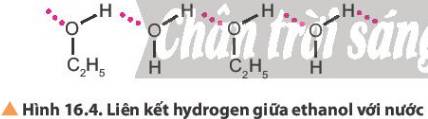
Do tạo được liên kết hydrogen với nước nên các alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng

a, Nhiệt độ sôi tăng dần theo độ lớn của PTK
b, Ở nhiệt độ phòng, cả 4 chất này đều là chất khí.
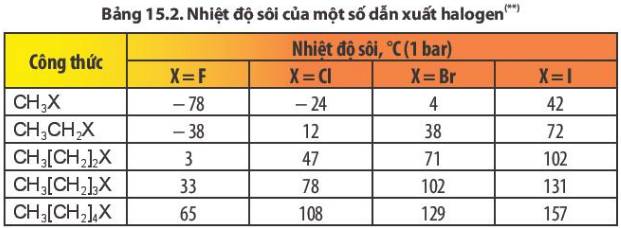
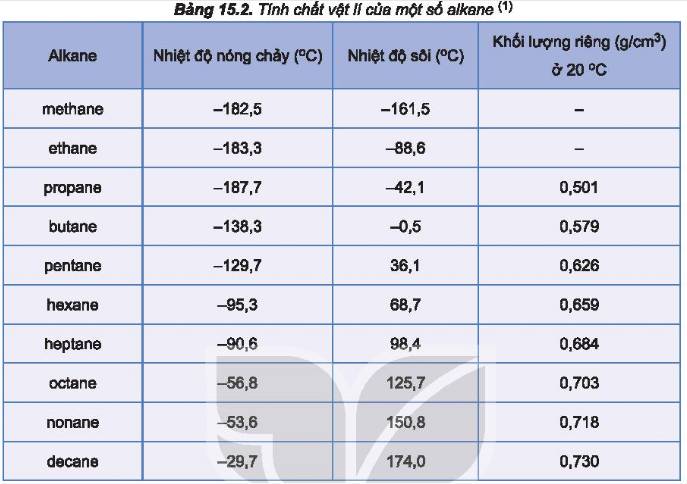

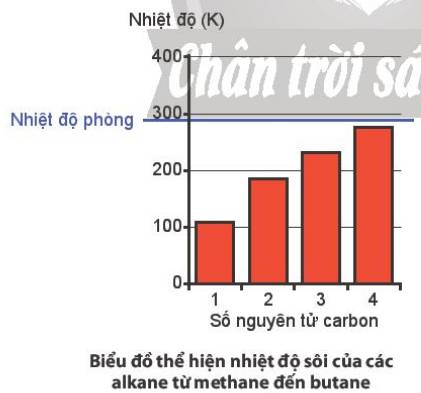
– Theo chiều tăng mạch cacbon (hàng dọc), nguyên từ khối tăng nhiệt độ sôi của các chất tăng dần.
- Khi nguyên tử khối tăng (theo hàng ngang), nhiệt độ sôi cùng giảm dần.
- Khi nguyên tử khối tăng cần tốn nhiều năng lượng để chuyển các phân tử hữu cơ sang trạng thái hơi nhiệt độ sôi tăng.