Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
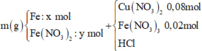
Y chứa 1 khí không màu hóa nâu trong không khí là NO
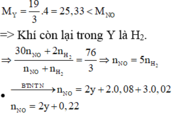
→ BTe 2 x = 2 . 0 , 08 + 0 , 02 + 2 . n H 2 + 3 . n N O = 0 , 18 + 17 5 . ( 2 y + 0 , 22 ) ( 1 )
Có khí H2 thoát ra chứng tỏ NO 3 - phản ứng hết, dung dịch X chứa FeCl2 và HCl dư.
Chất rắn không tan sau phản ứng là Cu:
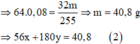
Từ (1) và (2) suy ra:
x = 0 , 6 y = 0 , 04 → BTNG . Fe n FeCl 2 = 0 , 6 + 0 , 04 + 0 , 02 = 0 , 66 mol
AgNO3 dư + X → 0,045 mol NO. 3 Fe 2 + + 4 H + + NO 3 - → 3 Fe 3 + + NO + 2 H 2 O 0 , 135 → 0 , 18 0 , 135 ← 0 , 045 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,525 → 0,525 0,525 0,525 mol
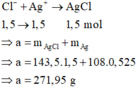
Gần nhất với giá trị 272,0

Đáp án B
Ta có sơ đồ phản ứng:
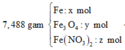
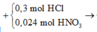

* Y + AgNO3
Bảo toàn nguyên tố Cl:
![]()
![]()
![]()
Fe2+ →Fe3+ + 1e
4H+ + NO−3 + 3e → NO + H2O
0,036 ← 0,027 ← 0,009
Ag+ + 1e → Ag
0,009 ← 0,009
Bảo toàn electron ta có: n F e 2 + = 0,027 + 0,009 = 0,036 mol
Dung dịch Y gồm: Fe2+ : 0,036 mol, H+ : 0,036 mol, Cl− : 0,3 mol, Fe3+
Bảo toàn điện tích ta có:
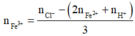
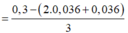
= 0,064 mol
* X + HNO3
n H + p h ả n ứ n g = 0,3 + 0,024 - 0,036 = 0,288 mol
![]()
Bảo toàn nguyên tố oxi ta có: 4b + 6c + 0,024.3 + 0,144 => 2b + 3c = 0,052 (1)
Ta có hệ phương trình:
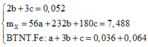
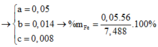
= 37,4 %.

Đáp án B
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3):
a = 0,05
b = 0,014
c = 0,008
=> %Fe = 37,4%

Đáp án B
Phương pháp:
Bảo toàn electron
Bảo toàn điện tích
Bảo toàn nguyên tố Fe, O, H
Hướng dẫn giải:
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3): a = 0,05 b = 0,014 c = 0,008
=> %Fe = 37,4%

Đáp án D
Do dd Y tác dụng với AgNO3 dư thu được NO nên dd Y chứa Fe2+, Fe3+, Cl-, H+ dư.
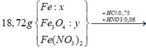
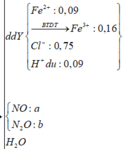
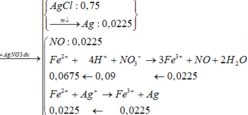
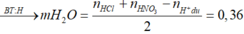
![]()
![]()
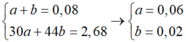
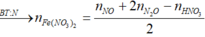
![]()
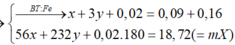
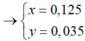
![]()
mFe3O4=0,035.232= 8,12g

Dung dịch Y chứa Fe3+ (a); Fe2+ (b), Cl- (0,88) và nH+ dư = 4nNO = 0,88 (mol)
Bảo toàn điện tích: 3a + 2b + 0,08 = 0,88 (1)
nAgCl = 0,88 => nAg = 0,07 (mol)
Bảo toàn electron: b = 0,03.2 + 0,07 (2)
Từ (1) và (2) => a = 0,18 và b = 0,13 (mol)
Quy đổi hỗn hợp thành Fe ( 0,31 mol) ; O ( u mol) và NO3- ( v mol). Trong Z, đặt nN2O = x => nNO2 = 0,2 – x (mol)
=> 0,31.56 + 16u + 62v = 27,04 (3)
Bảo toàn nguyên tố N:
v + 0,04 = 2x + (0,12 –x) (4)
nH+ pư = 0,88 + 0,04 – 0,08 = 0,84
=> 10x + 2( 0,12 –x) + 2u = 0,84 (5)
Từ (3), (4), (5) => u = 0,14 ; v = 0,12 ; x = 0,04
nFe(NO3)2 = v/2 = 0,06 (mol)
Đặt k, 3h, 2h, h lần lượt là số mol Fe, FeO, Fe3O4, Fe2O3
Bảo toàn Fe: => 0,06 + k + 11h = 0,31 (6)
Bảo toàn O : => 14h = u = 0,14 (7)
Từ (6) và (7) => k = 0,14 (mol); h = 0,01 (mol)
Số mol hỗn hợp = 0,06 + k + 6h = 0,26
=> %nFe = 0,14/0,26 = 53,85%
Gần nhất với 54%
Đáp án A

Đáp án C
Phân tích kết tủa:
0,88 mol Cl → 0,88 mol AgCl → 133,84 gam kết tủa còn 0,07 mol Ag nữa.
AgNO3 + dung dịch Y → 0,02 mol NO chứng tỏ trong Y chứa 0,08 mol H+.
Thêm nữa, kết tủa có Ag → chứng tỏ trong Y có Fe2+ → Y không chứa NO 3 - .
Rõ hơn quan sát sơ đồ:
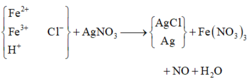
Theo đó, bảo toàn Ag có 0,95 mol AgNO3 → có 0,31 mol Fe(NO3)3.
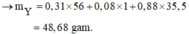
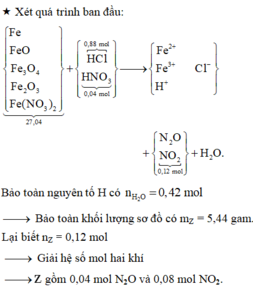
→ Bảo toàn nguyên tố N có số mol Fe(NO3)2 trong X là 0,06 mol.
Nhìn 27,04 gam X gồm 0,31 mol Fe + 0,12 mol NO3 + ? mol O → ? = 0,14 mol.
Lại có tỉ lệ FeO : Fe3O4 : Fe2O3 = 3:2:1
→ viết gộp cụm: 3FeO.2Fe3O4.1Fe2O3 = Fe11O14.
→ từ 0,14 mol O suy ra có 0,01 mol Fe11O14.
→ đọc ra có 0,03 mol FeO + 0,02 mol Fe3O4 + 0,01 mol Fe2O3.
→ nFe có trong X ban đầu = 0,31 - 0,11 - 0,06 = 0,14 mol
→ yêu cầu %nFe có trong hỗn hợp X
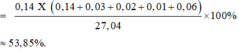

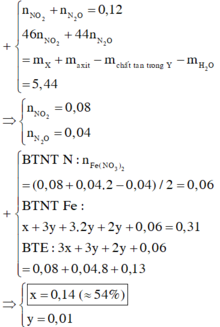
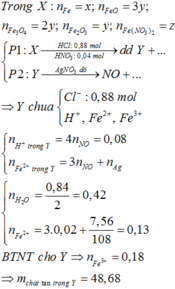
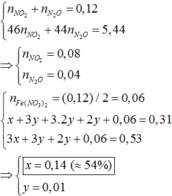
Đáp án C
Cho m gam hỗn hợp rắn gồm Fe, Fe(NO3)2 vào dung dịch chứa 0,08 mol Cu(NO3)2, 0,02 mol Fe(NO3)3 và HCl thu được dung dịch X và hỗn hợp hai khí không màu, có một khí hóa nâu trong không khí là NO
Ta có: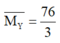 nên khí còn lại là H2 và tỉ lệ số mol NO: H2 là 5:1.
nên khí còn lại là H2 và tỉ lệ số mol NO: H2 là 5:1.
Cho AgNO3 dư vào dung dịch X thấy thoát ra 0,045 mol khí NO nên H+ dư trong X là 0,18 mol, do vậy X không chứa NO3-.
Mặt khác vì còn lại rắn không tan nên trong X chỉ chứa Fe2+ nên X chứa HCl dư và FeCl2.
Do còn H+ dư nên Fe hết ® rắn còn lại là Cu 0,08 mol
Gọi số mol Fe(NO3)2 là a mol; Fe là b mol và HCl là c mol
Bảo toàn N: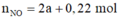
Bảo toàn H: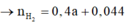
Bảo toàn nguyên tố Fe: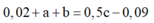
Giải hệ: a=0,04; b=0,6; c=1,5
Bảo toàn Cl: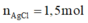
Bảo toàn e: