Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
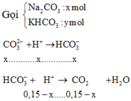
Ta có: 0,15 – x = 0,045 → x = 0,105 mol
HCO 3 - dư: x + y –(0,15 – x) = 2x + y – 0,15
![]()
→ 2x+ y – 0,15 = 0,15 → y = 0,09 → m = 20,13(g)

Đáp án D
Nhỏ từ từ axit vào dung dịch X ⇒ dung dịch Y.
⇒ Y chứa KCl và KHCO3.
Cho Y + dung dịch Ba(OH)2 dư ⇒ có phản ứng.
KHCO3 + Ba(OH)2 → BaCO3 + KOH + H2O.
+ Mà nKHCO3 = nBaCO3 = 0,2 mol.
+ Bảo toàn Cl ⇒ nKCl = nHCl = 0,5 mol.
⇒ Bảo toàn K ⇒ nKOH = nKCl + nKHCO3 = 0,7 mol.
⇒ CM KOH = 0,7/0,4 = 1,75M

Đáp án : C
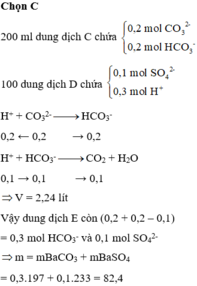
Sau khi trộn thì trong dung dịch có : 0,2 mol HCO3- và 0,2 molCO32-
D có : nH+ = 0,3 mol ; 0,1 mol SO42-
Khi nhỏ từ từ D và thì thứ tự phản ứng là :
CO32- + H+ -> HCO3-
HCO3- + H+ -> CO2 + H2O
=> Còn lại : 0,3 mol HCO3‑ ; 0,1 mol SO42-
Phản ứng với Ba(OH)2 => kết tủa gồm : 0,3 mol BaCO3 và 0,1 mol BaSO4
=> m = 82,4g
VCO2 = 0,1 mol = 2,24 lit

Đáp án B
► Xét TN1: đặt nCO32– phản ứng = a; nHCO3– phản ứng = b.
⇒ nCO2 = a + b = 0,15 mol; nHCl phản ứng = 2a + b = 0,1875 mol
||⇒ giải hệ có: a = 0,0375 mol; b = 0,1125 mol ⇒ nCO32–/X : nHCO3–/X = a : b = 1 : 3.
► Xét TN2: ∑nC/X = n↓ = 0,25 mol ⇒ 250 ml X chứa 0,5 mol C.
Bảo toàn nguyên tố Cacbon: y = 0,5 – 0,25 = 0,25 mol.
● Chia 0,5 mol C thành 0,125 mol CO32– và 0,375 mol HCO3–.
Bảo toàn điện tích: nK+ = 0,625 mol. Bảo toàn nguyên tố Kali:
x = 0,625 – 0,25 × 2 = 0,125 mol

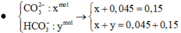
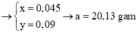
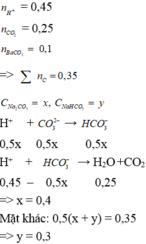
Đáp án A