Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
Dung dịch chứa NaOH và Ba(OH)2.
Đồ thị trải qua các giai đoạn:
+CO2 tác dụng với Ba(OH)2 tạo kết tủa BaCO3.
+CO2 tác dụng với NaOH tạo Na2CO3 sau đó CO2 tác dụng với Na2CO3 tạo NaHCO3.
+CO2 hòa tan kết tủa CaCO3.
Nhận lấy lúc 0,34 mol CO2 phản ứng thì kết tủa bị hòa tan còn 0,08 mol.
Vậy số mol HCO3- trong X là 0,26 mol (bảo toàn C)
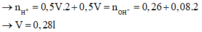

Chọn đáp án B.
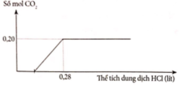
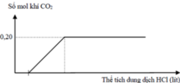
Cho từ từ dung dịch HCl vào dung dịch X:
Khi n H C l ≥ 0 , 28 m o l mol, số mol CO2 thoát ra không đổi và bằng 0,20 mol
=> Chứng tỏ khi n H C l = 0 , 28 m o l mol thì Na2CO3 và NaHCO3 phản ứng vừa hết.
⇒ n H C l = 2 n N a 2 C O 3 + n N a H C O 3 = 0 , 28 m o l n C O 2 = n N a 2 C O 3 + n N a H C O 3 = 0 , 2 m o l
⇒ n N a 2 C O 3 = 0 , 08 m o l n H C O 3 = 0 , 12 m o l
Cho từ từ 200 ml X vào dung dịch HCl.
Đặt số mol Na2CO3 và NaHCO3 lần lượt là A, B
⇒ n H C l = 2 a + b = 0 , 175 m o l a : b = 0 , 08 : 0 , 12
⇒ a = 0 , 05 b = 0 , 075
⇒ V = 2 , 8 l i t

Đáp án C
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Có n(H2SO4) = 0,12 (mol) và n(HCl) = 0,36 (mol)
→ n(BaSO4 max) = 0,12 mol và n(Al(OH)3 max) = 0,12 (mol)
Do kết tủa vẫn còn Al(OH)3 nên X phải có Al3+ → Dung dịch X không có OH- và AlO2-.
→ X có chứa Al3+ (0,12 mol); Na+ (a mol); H+ (b mol); Cl- (0,36 mol); SO42- (0,12 mol)
BT điện tích cho X: a + b = 0,12. 3 = 0,36 + 0,12. 2 (1)
Khi n(Ba(OH)2) = 0,28 mol hay n(OH-) = 0,56 mol thì Al(OH)3đã bị hòa tan hoàn toàn nên:
0,56 – b = 0,12. 4 → b = 0,08 → a = 0,16 mol
Vậy ban đầu n(Na2O) = a/2 = 0,08 mol và n(Al2O3) = 0,12 : 2 = 0,06 mol
→ m = 11,08 (g)

Chọn C
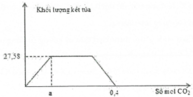
Cho hỗn hợp Na2O và Al2O3 vào 0,12 mol H2SO4 và 0,36 mol HCl thu được dung dịch X.
Cho Ba(OH)2 dư vào X ta thấy đồ thị như trên do vậy có các giai đoạn:
+Giai đoạn kết tủa tăng do tạo kết tủa BaSO4 và Al(OH)3.
+Kết tủa giảm do có sự hòa tan Al(OH)3.
+Kết tủa không đổi lúc này chỉ còn BaSO4.
Có n(H2SO4) = 0,12 (mol) và n(HCl) = 0,36 (mol)
→ n(BaSO4 max) = 0,12 mol và n(Al(OH)3 max) = 0,12 (mol)
Do kết tủa vẫn còn Al(OH)3 nên X phải có Al3+ → Dung dịch X không có OH- và AlO2-.
→ X có chứa Al3+ (0,12 mol); Na+ (a mol); H+ (b mol); Cl- (0,36 mol); SO42- (0,12 mol)
BT điện tích cho X: a + b = 0,12. 3 = 0,36 + 0,12. 2 (1)
Khi n(Ba(OH)2) = 0,28 mol hay n(OH-) = 0,56 mol thì Al(OH)3đã bị hòa tan hoàn toàn nên:
0,56 – b = 0,12. 4 → b = 0,08 → a = 0,16 mol
Vậy ban đầu n(Na2O) = a/2 = 0,08 mol và n(Al2O3) = 0,12 : 2 = 0,06 mol
→ m = 11,08 (g)
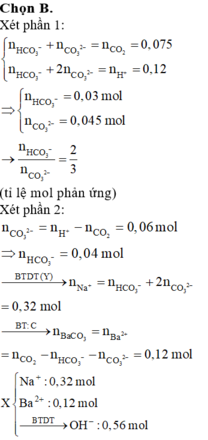
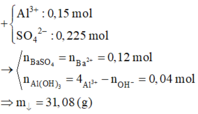

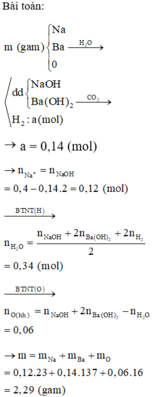

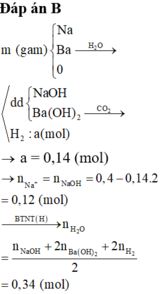


Đáp án D
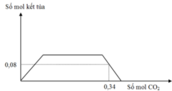
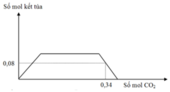
Dung dịch chứa NaOH và Ba(OH)2.
Đồ thị trải qua các giai đoạn:
+CO2 tác dụng với Ba(OH)2 tạo kết tủa BaCO3.
+CO2 tác dụng với NaOH tạo Na2CO3 sau đó CO2 tác dụng với Na2CO3 tạo NaHCO3.
+CO2 hòa tan kết tủa CaCO3.
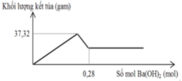
Nhận lấy lúc 0,34 mol CO2 phản ứng thì kết tủa bị hòa tan còn 0,08 mol.
Vậy số mol HCO3- trong X là 0,26 mol (bảo toàn C)