
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

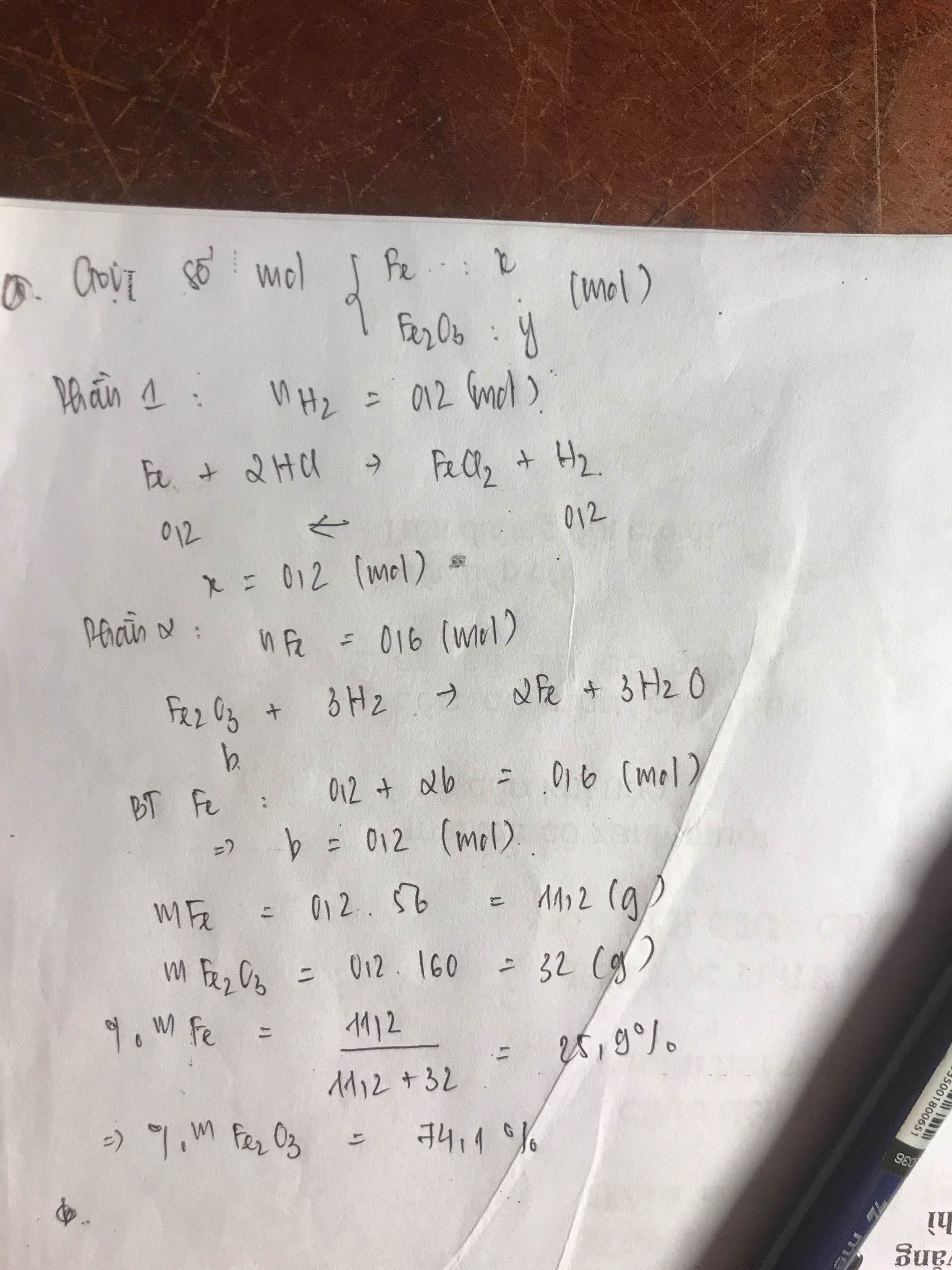

Sửa đề: 34,48 → 4,48
a, - Phần 1: \(Fe+2HCl\rightarrow FeCl_2+H_2\) (1)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\) (2)
- Phần 2: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\) (3)
b, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT (1): \(n_{Fe\left(1\right)}=n_{H_2}=0,2\left(mol\right)\)
\(n_{Fe}=\dfrac{33,6}{56}=0,6\left(mol\right)=n_{Fe\left(3\right)}+n_{Fe\left(1\right)}\)
\(\Rightarrow n_{Fe\left(3\right)}=0,4\left(mol\right)\)
Theo PT (3): \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(3\right)}=0,2\left(mol\right)\)
\(\Rightarrow m_X=2.\left(m_{Fe\left(1\right)}+m_{Fe_2O_3}\right)=2.\left(0,2.56+0,2.160\right)=86,4\left(g\right)\)

Gọi số mol Fe, Fe2O3 trong mỗi phần là a, b (mol)
P1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> a = 0,2 (mol)
P2:
\(n_{Fe}=\dfrac{33,6}{56}=0,6\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b---->3b-------->2b----->3b
=> 0,2 + 2b = 0,6
=> b = 0,2 (mol)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,2.160}.100\%=25,926\%\\\%m_{Fe_2O_3}=\dfrac{0,2.160}{0,2.56+0,2.160}.100\%=74,074\%\end{matrix}\right.\)
b) \(n_{H_2O}=3b=0,6\left(mol\right)\)
=> \(m_{H_2O}=0,6.18=10,8\left(g\right)\)

\(n_{Fe}=a,n_{Fe_2O_3}=b:trong.1.phần\\ Phần.I:\\ Fe_2O_3+3H_2->2Fe+3H_2O\\ n_{Fe}=a+2b=\dfrac{11,2}{56}=0,2\left(I\right)\\ Phần.II:\\ Fe+2HCl->FeCl2+H_2\\ a=\dfrac{2,24}{22,4}=0,1\\ b=0,05\\ \%m_{Fe}=\dfrac{56\cdot0,1}{56\cdot0,1+0,05\cdot160}=41,18\%\\ \Rightarrow\%m_{Fe_2O_3}=58,82\%\)

Trong mỗi phần, đặt nFe = a và nFe2O3 = b
Phần 1:
Fe2O3 + 3CO —to-> 2Fe + 3CO2
b………………………2b
mFe = 56(a + 2b) = 11,2 (1)
Phần 2:</p><p>Fe + 2HCl ->FeCl2 + H2
a……………………………..a
Fe2O3 + 6HCl —to> 2FeCl3 + 3H2
nH2 = a = 0,1 (2
(1)(2)=> a = 0,1 và b = 0,05
%Fe = 56a/(56a + 160b) = 41,18%
%Fe2O3 = 160b/(56a + 160b) = 58,82%

Phần 2:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____0,1<-----------------------0,1
=> nFe = 0,1 (mol)
Phần 1:
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
_______a-------------------->2a
=> 2a + 0,1 = \(\dfrac{11,2}{56}=0,2\)
=> a = 0,05
=> \(\left\{{}\begin{matrix}\%Fe=\dfrac{56.0,1}{56.0,1+160.0,05}.100\%=41,176\%\\\%Fe_2O_3=\dfrac{160.0,05}{56.0,1+160.0,05}.100\%=58,824\%\end{matrix}\right.\)

P2: Fe+2HCl→FeCl2+H2(1)
3Fe2O3+6HCl→FeCl3+H2O(2)
nH2=2,24/22,4=0,1(mol)
Theo (1) nFe=nH2=0,1(mol)
mFe(P2)=mFe(P1)=0,1.56=5,6(g)
∑nFe=11,2/56=0,2(mol)
⇒nFe2O3=(0,2−0,1)/2=0,05(mol)
mFe2O3=0,05.160=8(g)
%Fe=5,6/(5,6+8).100%=41,18%
%Fe2O3=100%−41,18%=58,82%

b. nFe=11,2/56=0,2mol
Theo PTHH trên thì 0,2 mol Fe PƯ sẽ tạo ra được 0,2 mol H2. Nhưng đề bài chỉ cho 0,1 mol
==> Quá dữ liệu đề bài
==>Fe Dư.
nFe pư=0,1.1/1=01mol
==>nFe ở PT1=0,1mol
==>nFe2O3=0,1.1/2=0,05Mol
==>mFe2O3=160.0,05=8g
==>mFe=8g
a,2Fe + O2 \(\rightarrow\) 2Fe0
\(Fe_2O_3+HCL\rightarrow FeCl_3+H_2O\)

a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt