
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.

Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
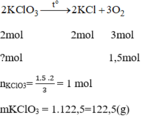
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
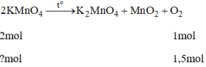
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.

Giả sử ta lấy cùng một khối lượng là a g
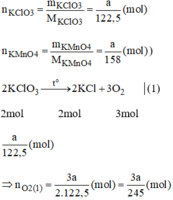
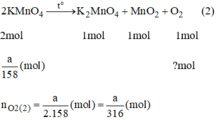
Vậy 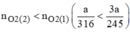 nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
K
C
l
O
3
nên khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là
K
C
l
O
3

\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
\(\dfrac{m}{122,5}\) \(\dfrac{3m}{245}\) ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(\dfrac{m}{158}\) \(\dfrac{m}{316}\) ( mol )
So sánh:
\(\dfrac{3m}{245}\) > \(\dfrac{m}{316}\)
=> \(KClO_3\) cho nhiều O2 hơn

KClO3 --> KCl + O2
2KMnO4 --> MnO2 + O2 + K2MnO4
Để tạo 1 mol O2 cần 1 mol KClO3 nhưng cần 2 mol KMnO4
Vậy khi thu được lượng oxi như nhau thì cần dùng lượng KMnO4 nhiều hơn
Gọi n là số mol của 2 phản ứng
PTHH:
\(2KClO_3\xrightarrow[t^o]{MnO_2}2KCl+3O_2\left(1\right)\)
\(2KMnO_4\overset{t^o}{--->}K_2MnO_4+MnO_2+O_2\left(2\right)\)
Theo PT(1): \(n_{KClO_3}=\dfrac{2}{3}n\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=122,5.\dfrac{2}{3}n=\dfrac{245}{3}n\left(g\right)\)
Theo PT(2): \(n_{KMnO_4}=2n\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=158.2n=316n\left(g\right)\)
Ta thấy: \(\dfrac{245}{3}n< 316n\)
Vậy KMnO4 dùng nhiều hơn

PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Coi mKClO3 = mKMnO4 = 1 (g)
Ta có: \(n_{KClO_3}=\dfrac{1}{122,5}\left(mol\right)\) \(\Rightarrow n_{O_2\left(KClO_3\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{245}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{1}{158}\left(mol\right)\Rightarrow n_{O_2\left(KMnO_4\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{316}\left(mol\right)\)
\(\Rightarrow\dfrac{3}{245}>\dfrac{1}{316}\)
Vậy: Cùng 1 khối lượng, KClO3 cho nhiều khí O2 hơn.
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Qua phương trình trên ta thấy đc KClO3 thu đc nhiều khí oxi hơn là KMnO4

KClO3 -to-> KCl + 3/2 O2
x/122,5________x________(1,5. x/122,5) (mol)
KMnO4 -to-> K2MnO4 + MnO2 + 1/2 O2
x/158_______________________(0,5. x/158) (mol)
Vì: (1,5. x/122,5=3/245x > 0,5. x/158= 1/316x )
=> KClO3 cho ra nhiều O2 hơn.

Giả sử ta lấy cùng một khối lượng là a gam
\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{a}{122,5}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{a}{158}\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (1)
Theo phương trình:
\(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}.\dfrac{a}{122,5}=\dfrac{3a}{245}\)
\(2KMnO_4\xrightarrow[]{t^2}K_2MnO_4+MnO_2+O_2\) (2)
Theo phương trình:
\(n_{O_2\left(2\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{a}{158}=\dfrac{a}{316}\left(mol\right)\)
Ta thấy: \(\dfrac{a}{316}< \dfrac{a}{245}\)
\(\Rightarrow n_{O_2\left(2\right)}< n_{O_2\left(2\right)}\)
Vậy khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là KClO3
\(PTHH:2KClO_3\underrightarrow{to}2KCL+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{to}K_2MnO_4+MnO_2+O_2\uparrow\)
Từ PTHH trên ta thấy đc rằng:
\(KClO_3\) sẽ điều chế khí oxygen nhiều hơn do phân huỷ nhiều Oxygen
