Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.M_{H_2}=2\left(g/mol\right)\\ M_{CH_4}=16\left(g/mol\right)\\ M_{SO_2}=64\left(g/mol\right)\\ M_{CO}=28\left(g/mol\right)\\ M_{NO_2}=46\left(g/mol\right)\\ M_{Cl_2}=71\left(g/mol\right)\\ M_{CO_2}=44\left(g/mol\right)\\ \Rightarrow Cl_2nặngnhất\)
b. Trong phòng thí nghiệm,\(H_2,CH_4,CO\) được thu theo phương pháp đặt ngược bình vì các khí này nhẹ hơn không khí
c.\(d_{O_2/H_2}=\dfrac{32}{2}=16\left(lần\right)\)

a) \(n_X=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\)
=> \(n_Y=0,5\left(mol\right)\)
Gọi số mol NO2, CH4 là a, b
=> a + b = 0,5
Có: \(\dfrac{46a+16b+0,5.M_Y}{1}=15.2\)
=> 46a + 16b + 0,5.MY = 30
Có: \(\dfrac{16b}{46a+16b+0,5.M_Y}.100\%=16\%\)
=> b = 0,3 (mol)
=> a = 0,2 (mol)
=> MY = 32(g/mol)
Mà Y là đơn chất
=> Y là O2
b) \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\)=> CH4 dư, O2 hết
=> Lượng O2 trong hỗn hợp trên không đủ để đốt cháy 6,72 lít CH4

1: B
2: C
Đó là: H2, CH4, NH3
Giải thích: Những khí được thu bằng phương pháp úp bình phải có khối lượng mol < khối lượng mol của không khí
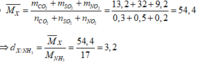
ta có :
dSO2/H2 = 64 : 2 = 32
tương tự vơi các chất còn lại ta có
CH4 = 8
NH3 = 8,5
NO2 = 46
=> sắp xếp : NO2 ; SO2 ; NH3 ; CH4 .