Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi khối lượng Na2SO4 trong dd ban đầu là a(g)
=> \(m_{H_2O}=1283-a\left(g\right)\)
=> \(S=\dfrac{a}{1283-a}.100=28,3\Rightarrow a=283\left(g\right)\)
Gọi khối lượng nước trong tinh thể là x
=> \(m_{H_2O\left(ddsau\right)}=1000-x\left(g\right)\)
=> \(S=\dfrac{m_{Na_2SO_4\left(ddsau\right)}}{1000-x}.100=28,3\Rightarrow m_{Na_2SO_4\left(ddsau\right)}=283-0,283x\left(g\right)\)
=>mNa2SO4 trong tinh thể =\(283+45,53-\left(283-0,283x\right)=0,283x+45,53\left(g\right)\)
=> mtinh thể = x + (0,283x + 45,53) = 161
=> x = 90
=> \(\left\{{}\begin{matrix}n_{Na_2SO_4}=\dfrac{71}{142}=0,5\left(mol\right)\\n_{H_2O}=\dfrac{90}{18}=5\left(mol\right)\end{matrix}\right.\)
=> \(n_{Na_2SO_4}:n_{H_2O}=0,5:5=1:10\)
=> CTHH: \(Na_2SO_4.10H_2O\)

. Do trộn 100g với 100g mà lượng dung dịch thu được < 200g thì muối sunfat kim loại là muối axit.( do sự thất thoát khí )
pt : 2MHSO4 + 2NaHCO3 = M2SO4 + Na2SO4 + 2CO2 + 2H2O
Sự thoát khí CO2 làm giảm khối lượng ( số mol CO2 = số mol NaHCO3 0,05mol)
gọi số mol của MHSO4 là x ta có:
(M + 97) x = 13,2 => x = 13,2/ (M + 97)
Theo phương trình sự tạo kết tủa với BaCl2 là muối sunfat:
MNaSO4 + BaCl2 = BaSO4 + MCl + NaCl
=> Với 0,1 < x < 0,1 + 0,02 thì 13< M < 35 thoả mãn Na = 23 Vậy công thức sunfat là NaHSO4

Hướng dẫn giải:
RO + H2SO4 → RSO4 + H2O
0,04 ←0,04
→ Oxit: FeO (72)
CTPT muối ngậm nước là: RSO4.nH2O
n = 0,04 và m = 7,52
=> M = 188
=> n = 2
=> FeSO4 . 2H2O
Vậy CTPT muối ngậm nước là: FeSO4.2H2O

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
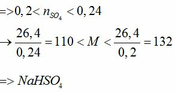
b)
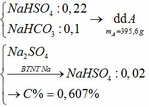
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

\(n_{H_2SO_4}\) = \(\frac{100.24,5\%}{98}\) = 0,25 (mol)
Gọi CTHH của oxit kim loại hóa trị ll là MO
MO + H2SO4 \(\rightarrow\) MSO4 + H2O
0,25<--- 0,25 ---> 0,25 (mol)
MMO = \(\frac{20}{0,25}\) = 80 (g/mol)
\(\Rightarrow\) M = 80 - 16 = 64 (g/mol)
\(\Rightarrow\) M = 64 đvC (Cu : đồng)
\(\Rightarrow\) CuO
Gọi CTHH của tinh thể là CuSO4 . nH2O
ntinh thể = nCuSO4 = 0,25 (mol)
M tinh thể = \(\frac{62,5}{0,25}\) = 250 (g/mol)
\(\Rightarrow\) 160 + 18n = 250
\(\Rightarrow\) n =5
\(\Rightarrow\) CTHH của tinh thể là CuSO4.5H2O

Giải:
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH:
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(0,2..........0,2..........0,2\)
\(m_{CUSO_4}=0,2.160=32\left(g\right)\)
\(m_{H_2SO_4}=0,2.\dfrac{98}{20}\%=98\left(g\right)\)
\(m_{CUSO_4}=16+98=114\left(g\right)\)
--> mnước (dd CuSO4) = 114 - 32 = 82 (g)
Gọi \(n_{CuSO_4}.5H_2O=x\left(mol\right)\)
--> mCuSO4 (dd CuSO4 sau) = 32 - 160x (g)
mH2O (dd CuSO4 sau) = 82 - 90x (g)
\(\rightarrow S\left(10^0C\right)=\dfrac{\left(32-160x\right)}{\left(82-90x\right)}=17,4\left(g\right)\)
\(\rightarrow x=0,122856\)
\(\rightarrow m_{CuSO_4.5H_2O}=0,122856.250=30,714\left(g\right)\)

Đặt kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4 -> MSO4 + H2O
C% = mct / mdd . 100%
20% = 1 . 98 / mdd . 100%
-> mDd H2SO4 = 490 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 490
= M + 506
C%muối = m chất tan muối/ m dd muối . 100%
20,87% = (M + 96) / (M + 506) * 100%
Giải pt trên =>M......

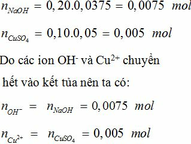

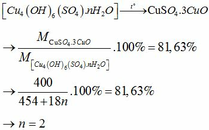
\(n_{BaCl_2}=0,6\cdot0,05=0,03mol\)
\(\Rightarrow n_{BaCl_2\cdot aH_2O}=n_{BaCl_2}=0,03mol\)
\(M_{BaCl_2.aH_2O}=\dfrac{7,32}{0,03}=244\)
\(\Rightarrow208+18a=244\Rightarrow a=2\)
Vậy muối là \(BaCl_2.2H_2O\)