Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

AgNO3 + Hcl -> AgCl + HNO3 (1)
nAgNO3=0,2(mol)
nHCl=0,6(mol)
=> Sau PƯ (1) còn 0,4 mol HCl dư
Từ 1:
nHNO3=nAgCl=nAgNO3=0,2(mol)
mAgCl=143,5.0,2=28,7(g)
C% dd HCl=\(\dfrac{36,5.0,4}{500-28,7}.100\%=3,1\%\)
C% dd HNO3=\(\dfrac{63.0,2}{500-28,7}.100\%=2,67\%\)

Đáp án C
Ta có: n C 6 H 12 O 6 = 1 2 . n Ag = 1 2 . 2 , 16 108 = 0 , 01 mol
→ CM(glucozơ) = n C 6 H 12 O 6 V C 6 H 12 O 6 = 0 , 01 50 . 10 - 3 = 0 , 2 M

nMg= 0.84/24=0.035 mol
PTHH: Mg +2HCl ----> MgCl2 + H2
0.035..................................0.035
VH2= 0.035*22.4=0.784 l

Đáp án C
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3= 1.0,1 = 0,1 mol
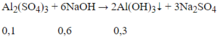
Vì NaOH dư nên:
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của Na[Al(OH)4]
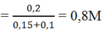
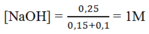

Đáp án B
1-đúng, Cr bị thụ động.
2-sai, CrO3 là oxit axit.
3-đúng.
4-sai, Cr tác dụng với Cl2 tạo ra CrCl3.
5-đúng.
6-sai, Cr hoạt động mạnh hơn Fe.

Đáp án B
Số mol AlCl3 là nAlCl3= 0,1.1 = 0,1 (mol)
Số mol Al2O3 là nAl2O3= 2,55/102 = 0,025 (mol)
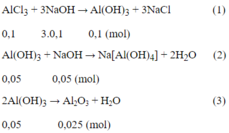
Theo pt (3) ta thấy số mol Al(OH)3 còn lại là 0,05 mol
Như vậy đã có: 0,1 - 0,05 = 0,05 mol Al(OH)3 đã bị hòa tan.
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
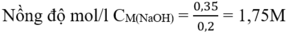

Đáp án B
1-đúng, Cr bị thụ động.
2-sai, CrO3 là oxit axit.
3-đúng.
4-sai, Cr tác dụng với Cl2 tạo ra CrCl3.
5-đúng.
6-sai, Cr hoạt động mạnh hơn Fe.
Bài này bạn cứ kết luận đề thiếu là được :D, khỏi cần "nghĩ mãi".
Nói: cô mà làm thí nghiệm ẩu như vậy biết đường nào mà lần để tính :)))