Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\\ n_{Cl_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Mg+Cl_2\rightarrow\left(t^o\right)MgCl_2\\ a,Vì:\dfrac{0,2}{1}< \dfrac{0,3}{1}\Rightarrow Mgdư\\n_{Mg\left(p.ứ\right)}=n_{MgCl_2}=n_{Cl_2}=0,2\left(mol\right)\\ \Rightarrow n_{Mg\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\\ m_{Mg\left(dư\right)}=0,1.24=2,4\left(g\right)\\ b,m_{MgCl_2}=0,2.95=19\left(g\right)\)
\(n_{Mg}=\dfrac{m}{M}=\dfrac{7,2}{24}=0,3\) (mol)
\(n_{Cl_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\)(mol)
PTHH : Mg + Cl2 ---> MgCl2
1 : 1 : 1
Dễ thấy : \(\dfrac{n_{Mg}}{1}>\dfrac{n_{Cl_2}}{1}\)
=> Mg dư 0,1 mol
=> \(m_{Mg}=n.M=0,1.24=2,4\left(g\right)\)
=> \(n_{MgCl_2}=0,2\left(mol\right)\) => \(m_{MgCl_2}=n.M=0,2.\left(24+71\right)=19\left(g\right)\)
\(n_{Mg}=\dfrac{m}{M}=\dfrac{7,2}{24}=0,3\) (mol)
\(n_{Cl_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\)(mol)
PTHH : Mg + Cl2 ---> MgCl2
1 : 1 : 1
Dễ thấy : \(\dfrac{n_{Mg}}{1}>\dfrac{n_{Cl_2}}{1}\)
=> Mg dư 0,1 mol
=> \(m_{Mg}=n.M=0,1.24=2,4\left(g\right)\)
=> \(n_{MgCl_2}=0,2\left(mol\right)\) => \(m_{MgCl_2}=n.M=0,2.\left(24+71\right)=19\left(g\right)\)

PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
Ta có: 23nNa + 137nBa = 18,3 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Ba}=0,2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Na}=0,2\left(mol\right)\\n_{Ba}=0,1\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{Ba\left(OH\right)_2}=n_{Ba}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{NaOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\\C_{M_{Ba\left(OH\right)_2}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)

a, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,5}{2}\), ta được HCl dư.
Theo PT: \(n_{HCl\left(pư\right)}=2n_{Fe}=0,2\left(mol\right)\Rightarrow n_{HCl\left(dư\right)}=0,5-0,2=0,3\left(mol\right)\)
\(\Rightarrow m_{HCl\left(dư\right)}=0,3.36,5=10,95\left(g\right)\)
b, \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
c, \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
d, \(m_{HCl}=0,5.36,5=18,25\left(g\right)\Rightarrow C\%_{HCl}=\dfrac{18,25}{200}.100\%=9,125\%\)
\(a.n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ n_{HCl}=0,5.1=0,5mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\dfrac{0,1}{1}< \dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{HCl}=2n_{Fe}=0,2mol\\ m_{HCl\left(dư\right)}=\left(0,5-0,2\right).36,5=10,95\%\\ b)n_{Fe}=n_{FeCl_2}=n_{H_2}=0,1mol\\ m_{FeCl_2}=0,1.12,7g\\ c)V_{H_2}=0,1.22,4=2,24l\\ d)C_{\%HCl}=\dfrac{0,2.36,5}{200}\cdot100=3,65\%\)

Sửa đề: "3,36 lít CO2"
Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=\dfrac{18}{40}=0,45\left(mol\right)\\n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Bazơ dư nên tính theo CO2
Theo PTHH: \(n_{Na_2CO_3}=0,15\left(mol\right)=n_{NaOH\left(dư\right)}\) \(\Rightarrow\left\{{}\begin{matrix}m_{Na_2CO_3}=0,15\cdot106=15,9\left(g\right)\\m_{NaOH}=0,15\cdot40=6\left(g\right)\end{matrix}\right.\)

2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
\(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,15\left(mol\right)\)
=> VSO2=0,15.22,4=3,36(lit)
=> Chọn C
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : Fe + 2H2SO4 → FeSO4 + SO2 + 2H2O\(|\)
1 2 1 1 2
0,1 0,1
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Thể tích của khí lưu huỳnh ddioxxit ở dktc
VSO2 = nSO2 . 22,4
= 0,1. 22,4
= 2,24 (l)
⇒ Chọn câu : A
Chúc bạn học tốt

\(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
Gọi số mol Al, Fe là a, b
=> 27a + 56b = 2,78
2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b--------------->b----->b
=> 1,5a + b = 0,07
=> a = 0,02; b = 0,04
=> mFeCl2 = 0,04.127 = 5,08 (g)
=> C

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Zn}\) \(\Rightarrow n_{ZnO}=\dfrac{20-0,1\cdot65}{81}=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow n_{ZnCl_2}=n_{Zn}+n_{ZnO}=\dfrac{4}{15}\left(mol\right)\)
Mặt khác: \(m_{H_2}=0,1\cdot2=0,2\left(g\right)\)
\(\Rightarrow m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=119,8\left(g\right)\) \(\Rightarrow C\%_{ZnCl_2}=\dfrac{\dfrac{4}{15}\cdot136}{119,8}\cdot100\%\approx30,27\%\)
c) Giả sử khí là SO2
PTHH: \(Zn+H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}ZnSO_4+SO_2\uparrow+H_2O\)
Theo PTHH: \(n_{SO_2}=n_{Zn}=0,1\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,1\cdot22,4=2,24\left(l\right)\)

PTHH: Na + H2O -> NaOH + 1/2 H2
a) nNa= 4,6/23= 0,2(mol) -> nNaOH=0,2(mol); nH2=0,1(mol)
V(H2,đktc)=0,1.22,4=2,24(l)
=> CMddNaOH= 0,2/0,1=2(M)
b) nNa= 4,6/23= 0,2(mol) -> nNaOH=0,2(mol); nH2=0,1(mol)
=>V(H2,đktc)=0,1.22,4=2,24(l)
CMddNaOH= 0,2/0,05=4(M)
a) Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,2 0,2 0,1
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,1 . 22,4
= 2,24 (l)
Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
100ml = 0,1l
Nồng độ mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,2}{0,1}=2\left(M\right)\)
b) Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,2 0,2 0,1
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,1 .22,4
= 2,24 (l)
Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
50ml = 0,05l
Nồng độ mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,2}{0,05}=4\left(M\right)\)
Chúc bạn học tốt
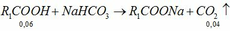
\(a,n_{Na}=\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{Cl_2}=\dfrac{V_{Cl_2\left(đktc\right)}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ PTHH:2Na+Cl_2\rightarrow2NaCl\\ Vì:\dfrac{0,2}{2}< \dfrac{0,2}{1}\Rightarrow Cl_2dư\\ \Rightarrow n_{Cl_2\left(dư\right)}=0,2-\dfrac{0,2}{2}=0,1\left(mol\right)\\ \Rightarrow m_{Cl_2\left(dư\right)}=0,1.71=7,1\left(g\right)\\ b,n_{NaCl}=n_{Na}=0,2\left(mol\right)\\ \Rightarrow m_{NaCl}=58,5.0,2=11,7\left(g\right)\)