Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NO}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(\Rightarrow n_{NO_3^-}=3n_{NO}=0,09\left(mol\right)\)
\(\Rightarrow m_{mk}=m_{kl}+m_{NO_3^-}=29+5,58=34,58\left(g\right)\)

- Viết đúng ptpư:
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+2H_2O\)
\(3Cu+8HNO_3\rightarrow2Cu\left(NO_3\right)_2+2NO+4H_2O\)
\(nNO=0,04\left(mol\right)\)
Gọi nFe là x(mol) ; nCu là y(mol)
ta có hệ pt:
\(\left\{{}\begin{matrix}m_{hh}=56x+64y=3,04\\nNO=x+\dfrac{2}{3y}=0,04\end{matrix}\right.\)
Giải hệ ta được: x = 0,02 mol ; y = 0,03 mol
\(\Rightarrow mFe=0,02.56=1,12\left(g\right)\)
\(mCu=0,03.64=1,92\left(g\right)\)

Đáp án A
nNO = 2,8/22,4 = 0,125 (mol)
BTNT N: nNO3 ( trong muối) = 3nNO = 0,375 (mol)
=> mmuối = mKL + mNO3- = 7,55 + 0,375.62 = 30,8 (g)

Coi như hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 gồm có x mol Fe và y mol O
Ta có 56x+16y= 11,36 (1)
Ta có nNO= 0,06 mol
QT cho e :
Fe → Fe3++ 3e
x 3x mol
QT nhận e :
O+ 2e→ O-2
y 2y mol
N+5+ 3e → NO
0,18←0,06
Theo ĐL BT electron thì : ne cho= ne nhận nên 3x= 2y+ 0,18 (2)
Từ (1) và (2) ta có x= 0,16 và y= 0,15
Bảo toàn nguyên tố Fe có nFe(NO3)3= nFe= x= 0,16 mol→ mFe(NO3)3=38,72 gam
Đáp án D

Quy đổi hỗn hợp Fe(a), O(b)
->56a+16b=17.2
mmuối =56a+62(2b+0,1.3)=57.4
->a=0.25,b=0.2
Dễ thấy 2a<2b+0,1.3<3a nên muối chưa Fe 2+ và Fe3+
->HNO3 hết
BT e: 2a+2nCu=2b+0,1.3
->nCu=0,1

Đáp án C
Z gồm CO và CO2
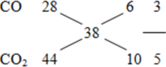
⇒nCO = 0,15 mol ;
n
C
O
2
= 0,25 mol
⇒ nO bị chiếm = 0,25 mol
⇒ nO còn lại = 0,2539m/16−0,25 mol
nNO = 7,168/22,4 = 0,32 mol
Coi hỗn hợp Y gồm kim loại: 0,7461m (gam) và O: 0,2539m/16−0,25 (mol)
Ta có:
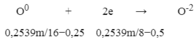
O0 + 2e → O-2
0,2539m/16−0,25 0,2539m/8−0,5
N+5 + 3e → N+2
0,96 0,32
⇒ m muối = m KL +
m
N
O
3
-
trong muối
= 0,7461m + 62. (0,2539m/8−0,5+0,96)
⇒ 3,456m = 2,714m + 28,52
⇔ m = 38,45 gam
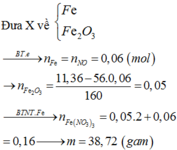

Kiến thức cần nhớ: \(Fe,Cu,Ag+HNO_{3\left(l\right)}\rightarrow NO\)
\(+HNO_{3\left(d\right)}\rightarrow NO_2\)
Vậy trong trường hợp này tạo khí NO
\(n_{NO}=\frac{1,008}{22,4}=0,045\left(mol\right)\)
\(n_{NO_3^-}=n.M=3n_{NO}=0,135\left(mol\right)\)
\(\Rightarrow m_{mk}=m_{kl}+m_{NO_3^-}=43,5+4,05=47,55\left(g\right)\)