Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Ta có n N a C l = 0 , 18 m o l
Trong thời gian t giây ở anot thu được 0,15 mol khí trong đó có 0,09 mol Cl2 và còn lại là O2 0,06 mol.
n e = 0 , 09 . 2 + 0 , 06 . 4 = 0 , 42 m o l
Khi thời gian điện phân là 2 t giây
→ n e = 0 , 84 m o l
Vậy ở anot thu đươc 0,09 mol Cl2 và 0,165 mol O2.
Vậy ở catot thu được H2 0,17 mol.
Bảo toàn e: n M = 0 , 84 - 0 , 17 . 2 2 = 0 , 25 m o l = n M S O 4 . 5 H 2 O
Vậy M là Ni (59).
Tại thời gian t giây ta thu được ở catot là 0,21 mol Ni
=> m= 12,39 gam

Đáp án A.
Ta có: nCl- = 1,2.0,25 = 0,3 mol
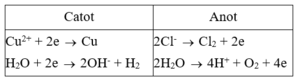
Catot
Cu2+ + 2e → Cu
H2O + 2e →2OH- + H2
Anot
2Cl- → Cl2 + 2e
2H2O → 4H+ + O2 + 4e
- Điện phân trong 5250 giây, nkhí anot = 0,18 mol > nCl
Do đó, ở anot có khí O2 thoát ra: nO2 = 0,18 – 0,15 = 0,03 mol
→ I = neF/t = (0,03.4 + 0,15.2).96500/5250 = 7,72A
Điện phân trong 9450 giây, ne điện phân = (9450.7,72)/96500 = 0,756 mol
Ở anot: nO2 = 7,72.(9450-28950/7,72)/(4.96500) = 0,114 mol
Ở catot: nH2 = 6,272/22,4 -0,114 – 0,15 = 0,016 mol
→nCu2+ = (0,756 -2.0,016)/2 = 0,362 mol → m = 0,362.250 = 90,5 gam
Trong 5250 giây: nCu2+ (bị điện phân) = 5252.7,72/2.96500 = 0,21 mol → Cu2+ dư 0,152 mol.
- Nhúng thanh Mg vào dung dịch chứa 0,152 mol Cu2+và 0,12 mol H+.
→mMg tăng = 0,152.(64-24) -24.1/2.0,12 = 4,64 gam

Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b
=> a+b=0,12
Bảo toàn e: n e = 2 a + 4 b
Lúc 2t giây: n e = 4 a + 8 b
Lúc này ở anot thu được Cl2 a mol và O2 → n O 2 = 4 a + 8 b - 2 a 4 = 0 , 5 a + 2 b
Do vậy ở catot thu được là H2 với số mol H2 = 0 , 5 a + 2 b + a 3 = 0 , 5 a + 2 b 3
Bảo toàn e:
n C u 2 + = 2 a + 4 ( 0 , 5 a + 2 b ) - 2 ( 0 , 5 a + 2 b 3 ) 2 = 1 , 5 a + 10 b 3 → 64 ( 1 , 5 a + 10 b 3 ) = 18 , 56
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.




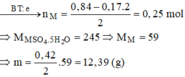





Đáp án B